
����Ŀ���Ӻ�ˮ�п��Ի�õ�ˮ��ʳ�β�����ȡþ��������ʣ�
��1����ˮ�����ķ�����Ҫ������һ�֣���
��2���������ʲ���Ҫ������ѧ�仯���ܴӺ�ˮ�л�õ��������� ��������ţ���
A.Һ��
B.ʳ��
C.����
D.��ˮ
��3���Ӻ�ˮ����ȡ���þ���������£� 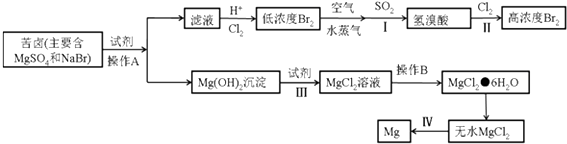
��д�����в�������ӷ���ʽ��ѧ����ʽ��
����I�Ļ�ѧ����ʽ�� ��
����III�����ӷ���ʽ�� ��
����IV�Ļ�ѧ����ʽ�� ��
�ڲ���A�� �� ����B�� �� �Ӳ���II�õ�����Һ����ȡ�廹��Ҫ���еIJ����У�����ȡ������
���𰸡�
��1������
��2��BD
��3��SO2+Br2+H2O�T�T2HBr+H2SO4�� Mg��OH��2+2H+=Mg2++2H2O�� MgCl2�����ڣ� ![]() Mg+Cl2�������ˣ���ȴ�ᾧ����Һ
Mg+Cl2�������ˣ���ȴ�ᾧ����Һ
���������⣺��1����ˮ�����ij��÷���Ϊ����ˮ���ᷨ�������������������ӽ�������
�ʴ�Ϊ����ˮ���ᷨ�������������������ӽ�������ѡ������һ��������2��A��ͨ����������Ȼ��Ƶõ��ƺ��������ǻ�ѧ�仯��ͨ������������������Ϊ�嵥�ʣ��ǻ�ѧ�仯����A����
B���Ѻ�ˮ��̫����ɹ������ˮ�ֺ�ʳ�Σ�����Ҫ��ѧ�仯���ܹ��Ӻ�ˮ�л�ã���B��ȷ��
ͨ����������Ȼ��Ƶõ��ƺ��������ǻ�ѧ�仯��ͨ��������ڵ��Ȼ�þ������������þ�������ǻ�ѧ�仯����B��ȷ��
C����ˮ����Ԫ��Ϊ����̬�����ˮ�������������ⱥ��ʳ��ˮ�������������˻�ѧ��Ӧ���ǻ�ѧ�仯����C����
D���Ѻ�ˮ������ȷ������Եõ���ˮ����ѧ�仯����D��ȷ��
�ʴ�Ϊ��BD����3���ٲ���I�Ƕ���������嵥�ʷ���������ԭ��Ӧ����������廯�⣬��Ӧ�Ļ�ѧ����ʽΪ��SO2+Br2+H2O�T�T2HBr+H2SO4 ��
�ʴ�Ϊ��SO2+Br2+H2O�T�T2HBr+H2SO4 ��
����III��������þ�ܽ������������Ȼ�þ��Һ����Ӧ�����ӷ���ʽΪ��Mg��OH��2+2H+=Mg2++2H2O��
�ʴ�Ϊ��Mg��OH��2+2H+=Mg2++2H2O��
����IV�ǵ�������Ȼ�þ�õ�����þ����������Ӧ�Ļ�ѧ����ʽΪ��MgCl2�����ڣ� ![]() Mg+Cl2����
Mg+Cl2����
�ʴ�Ϊ��MgCl2�����ڣ� ![]() Mg+Cl2����
Mg+Cl2����
�ڲ���A�Ƿ���������Һ�IJ���Ϊ���ˣ�����B����Һ�з���õ����ʹ���IJ�����ͨ��������Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬�Ӳ���II�õ�����Һ����ȡ�廹��Ҫ���еIJ�������ȡ��Һ������õ�Һ�壬
�ʴ�Ϊ�����ˣ���ȴ�ᾧ����Һ��
��1�����ݺ�ˮ�����ij��÷�������ˮ���ᷨ�������������������ӽ���������2���Ӻ�ˮ�����ʵ�ԭ��ȥ������
A����ˮ����Ԫ��Ϊ���ӣ��仯Ϊ������Ҫ������ѧ��Ӧ��
B����ˮ��̫����ɹ������ˮ�ֺ�ʳ�Σ�
C����Ԫ�غ�ˮ�д����ǻ���̬���仯Ϊ������Ҫ������ѧ��Ӧ��
D����ˮ�����Ƿ��������ˮ���仯�����������������ɣ��������仯����3����±����Ҫ������þ���廯þ�������Լ��������Ƴ���þ���ӹ��˵õ�������þ�����������Լ���Ϊ���ᣬ������þ�ܽ�������õ��Ȼ�þ��Һ��ͨ������B����Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬���Ȼ��������м���ʧȥ�ᾧˮ�õ������Ȼ�þ��������ǵ������Ȼ�þ�õ�����þ������������þ���Ӻ����Һ���ữͨ���������������������嵥�ʣ��õ���Ũ�ȵ��嵥����Һ���ÿ��������嵥�ʣ��ö����������շ���������ԭ��Ӧ�����廯�⣬��ͨ�����������廯��õ���Ũ�ȵ��嵥�ʣ�
�ٲ���I�Ƕ���������嵥�ʷ���������ԭ��Ӧ����������廯�⣻
����III��������þ�ܽ������������Ȼ�þ��Һ
����IV�ǵ�������Ȼ�þ�õ�����þ��������
�ڷ�����֪����A�Ƿ���������Һ�IJ���Ϊ���ˣ�����B����Һ�з���õ����ʹ���IJ�����ͨ��������Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬�Ӳ���II�õ�����Һ����ȡ�廹��Ҫ���еIJ�������ȡ��Һ������õ�Һ�壻



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������2FeCl3+Cu��2FeCl2+CuCl2��Ƴ�ԭ��أ��������������ɵ������ǣ�������
A. Cl- B. Fe2+ C. Cu2+ D. Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ù���dz��ÿ�����֮һ����������ijЩϸ����������ɱ����Щϸ�����Է��ס���Ĥ�ס���Ѫ֢���������õ���Ч��ʹ����ù��ǰһ��Ҫ����Ƥ�ԣ�һ������Ƥ�Ժ�ȴ��ʱ��۲� (����)
A.5����
B.10����
C.20����
D.30����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 g��1.17 g NaCl��0.84 g NaF����Һ�У��μӹ�����AgNO3��Һ�����ã����ˣ�ϴ�ӣ����صõ�2.87 g���壬�ɴ˿��Եó�����ȷ������(����)
A. ������ֻ��һ���ֲμӷ�Ӧ
B. ������ֻ��һ���ֲμӷ�Ӧ
C. ��������AgNO3����Һ����������
D. ������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���в������Ȼ�ͭ��ĩ13.5 g(�ں�һ������)������������AgNO3��Һ��Ӧʱ������29 g AgCl���������ĩ�е����ʿ�����(����)
A. FeCl3 B. KCl C. ZnCl2 D. BaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��һ�־��й���ζ�ĺϳ����ϣ���ͼΪ�ϳ�X��ij�����̣� 
��֪���� ![]() �������ձ�����Ϊ��COOH��
�������ձ�����Ϊ��COOH��
��D�IJ���������������һ�����ҵ�ʯ�ͻ���ˮƽ��
�ش��������⣺
��1��D��C�����й����ŵ����Ʒֱ�Ϊ �� E�Ľṹ��ʽ�� ��
��2��D��E�ķ�Ӧ����Ϊ ��
��3������A��B��C��D��E��X���������У���Ϊͬϵ�����������ĸ���ţ���
��4����ӦC+E��X�Ļ�ѧ����ʽΪ ��
��5����ӦA��B�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڱ���ͬ��Ԫ�ص������ԣ���Ԥ��Ԫ�ص����ʣ�
��1��PԪ�صĻ�̬ԭ������δ�ɶԵ��ӣ����ķ���ʽΪP4 �� ��ṹ��ͼ1��ʾ�� 
��ѧ��Ŀǰ�ϳ���N4���ӣ�Nԭ�ӵ��ӻ���������� �� N��N���ļ���Ϊ��N4�ֽ���ܲ���N2���ͷų������������Ʋ�����;Ϊ ��
��2��N��P��Asԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ ��
��3��������������Ľṹ��ͼ2��ʾ��
�þ����У�Bԭ�������Nԭ�ӵ���϶����ռ�ݴ����϶�ı���Ϊ ����ٷ�������
��4��N��As��ͬ��Ԫ�أ�B��Ga��ͬ��Ԫ�أ������黯�ؾ�����������������ṹ���ƣ����־������۵�ϸߵ����������黯�ؾ���ľ����߳�Ϊa pm�������ܶ�Ϊgcm��3 ���ú�a��ʽ�ӱ�ʾ����NAΪ�����ӵ�������ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒ������Ʒ�ڿ����в��ױ���ʴ��ԭ���ǣ� ��
A. ���Ľ����Ա�����B. ���ڿ��������������γ�һ�����ܵ�����Ĥ
C. �����ܶȱ������ܶ�СD. ������������������ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵��ǣ� �� 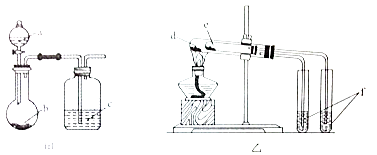
ѡ�� | ʵ���Լ� | ʵ����� | ||
A | a��ϡ���� | b��̼������ | c����������Һ | ���ԣ����̼����� |
B | a��ϡ���� | b���������� | c���廯����Һ | �����ԣ�MnO2��Cl2��Br2 |
C | d��С�մ� | e���մ� | f��ʯ��ˮ | ���ȶ��ԣ��մ�С�մ� |
D | d���Ȼ��� | e���Ȼ�� | f����������Һ | �е㣺�Ȼ��ƣ��Ȼ�� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com