
【题目】利用周期表中同族元素的相似性,可预测元素的性质.
(1)P元素的基态原子有个未成对电子,白磷的分子式为P4 , 其结构如图1所示. 
科学家目前合成了N4分子,N原子的杂化轨道类型是 , N﹣N键的键角为;N4分解后能产生N2并释放出大量能量,推测其用途为 .
(2)N、P、As原子的第一电离能由大到小的顺序为 .
(3)立方氮化硼晶体的结构如图2所示:
该晶体中,B原子填充在N原子的空隙,且占据此类空隙的比例为 (填百分数).
(4)N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是;立方砷化镓晶体的晶胞边长为a pm,则其密度为gcm﹣3 (用含a的式子表示,设NA为阿伏加德罗常数的值).
【答案】
(1)3;sp3;60°;制造火箭推进剂或炸药
(2)N>P>As
(3)正四面体;50%
(4)氮化硼;![]()
【解析】(1)P元素原子价电子排布式为3s22p3 , 基态原子有3个未成对电子,N4分子与P4结构相似,为正四面体构型,N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N﹣N 键的键角为60°;N4分解后能产生N2并释放出大量能量,可以制造火箭推进剂或炸药, 所以答案是:3;sp3;60°;制造火箭推进剂或炸药;(2)同主族自上而下第一电离能减小,故第一电离能:N>P>As,所以答案是:N>P>As;(3)B原子周围的4个N原子形成正四面体结构;每个晶胞中由8个这样的正四面体结构,只有4个填充B原子,B原子占据此类空隙的比例为50%,所以答案是:正四面体;50%;(4)立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径N<As、B<Ga,故氮化硼中共价键更强,氮化硼的晶体熔点更高,晶胞中As、Ga原子数目均为4,晶胞质量为4× ![]() g,晶胞密度为4×
g,晶胞密度为4× ![]() g÷(a×10﹣10 cm)3=
g÷(a×10﹣10 cm)3= 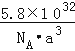 g.cm﹣3 , 所以答案是:氮化硼;
g.cm﹣3 , 所以答案是:氮化硼; 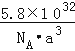 .
.


科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2 , K2=5.4×10﹣5 . 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是 , 由此可知草酸晶体分解的产物中有 . 装置B的主要作用是 .
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验. 
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 . 装置H反应管中盛有的物质是 .
②能证明草酸晶体分解产物中有CO的现象是 .
(3)①设计实验证明:
①草酸的酸性比碳酸的强 .
②草酸为二元酸 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
A.分子式为C5H10 的烯烃
B.分子式为C4H8O2 的酯
C.甲苯( ![]() )的一氯代物
)的一氯代物
D.立体烷( ![]() )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有(填一种);
(2)下列物质不需要经过化学变化就能从海水中获得的物质是 (填序号);
A.液溴
B.食盐
C.氢气
D.淡水
(3)从海水中提取溴和镁的流程如下: 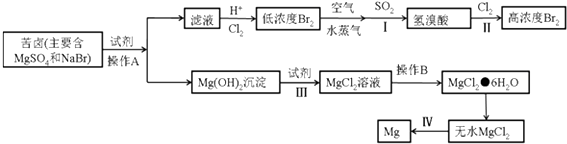
①写出下列步骤的离子方程式或化学方程式,
步骤I的化学方程式: ,
步骤III的离子方程式: ,
步骤IV的化学方程式: .
②操作A是 , 操作B是 , 从步骤II得到的溶液中提取溴还需要进行的操作有:、萃取、蒸馏.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并注明(1)、(2)、(3)的反应类型
(1)由乙烯制备聚乙烯的反应反应类型:
(2)用甲苯制TNT的反应反应类型:
(3)溴乙烷与NaOH的乙醇溶液共热反应类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G 为肉桂酸乙酯,是一种天然香料,自然界产量较低,利用A 可合成肉桂酸乙酯,其路线如下: 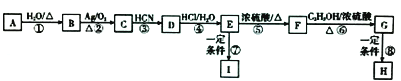
已知:①A 属于单取代芳香烃,其相对分子质量为104.
②  ③肉桂酸乙酯的结构简式为
③肉桂酸乙酯的结构简式为 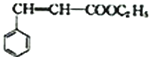
④I、H 均为高分子化合物.
按要求回答下列问题:
(1)A 的结构简式为;C 的化学名称为 .
(2)由C 生成D 的反应类型为;由F 生成G 的化学方程式为 .
(3)反应⑦⑧生成高分子化合物反应原理(填“相同”或“不相同”),若H 的平均相 对分子质量为10630,则其平均聚合度约为(填编号).
a.56 b.58 c.60 d.62
(4)K 的相对分子质量比G 的大2,K 的同分异构中能同时满足下列条件的共有种
(不含立体异构).
①能发生银镜反应; ②加入氯化铁溶液呈紫色; ③苯环上有三个间位的取代基.
其中核磁共振氢谱显示为6 组峰,且峰面积比例为9:1:1:1:1:1 的是
(写结构简式).
(5)根据上述有关信息和合成路线表示方式,写出C2H5OH 的原料合成乳酸 ( ![]() )的路线(其他试剂任选) .
)的路线(其他试剂任选) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化肥的合成、废水的处理等有现实的重要意义.
(1)硝酸铵的生产方法是采用硝酸与氨气化合,工业合成氨是一个放热反应,因此低温有利于提高原料的转化率,但实际生产中却采用400~500℃的高温,其原因是;工业生产中,以氨气为原料合成硝酸,写出工业生产硝酸的最后一步的化学方程式 .
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:![]() 已知:CO+H2O
已知:CO+H2O ![]() CO2+H2
CO2+H2
①甲厂以焦炭和水为原料;
②乙厂以天然气和水为原料;
③丙厂以石脑油(主要成分为C5H12)和水为原料.
按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高.据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高? .
(3)将工厂废气中产生的SO2通过下列流程如图1,可以转化为有应用价值的硫酸钙等.
①写出反应Ⅰ的化学方程式: .
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是 .
③检验经过反应Ⅲ得到的氨态氮肥中SO42﹣所用试剂是 . 
(4)工业上利用氯碱工业产品治理含二氧化硫的废气.图2是氯碱工业中电解饱和食盐水的原理示意图.
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 .
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如图),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( ) 
A.充电时电极a连接电源的负极
B.放电时负极的电极反应式为Zn﹣2e﹣=Zn2+
C.放电时左侧电解质储罐中的离子总浓度增大
D.阳离子交换膜可阻止Br2与Zn直接发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示. 
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是: ②; .
③; .
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为;
(3)该反应的△H0,其判断理由是
(4)该反应进行到4.0min时的平均反应速率: 实验②:vB=
实验③:vc= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com