
【题目】电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。
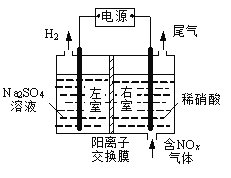
(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式: 。
②若有标准状况下2.24 LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为 mol。
(2)某小组在右室装有10 L 0.2 mol/L硝酸,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2mol/L硝酸溶液,需量取 mL的密度为1.4 g/mL、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 molHNO3、0.1 molHNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比(假设尾气中不含氮氧化物,写出计算过程)。
【答案】(1)①NO2-e-+H2O = NO+2H+ ②0.1;(2)①142.9;
②根据原子守恒: n(NO)+ n(NO2)=3 mol- 0.2 mol/L×10 L+0.1 mol =1.1 mol
根据电子守恒:0.1 mol×1+ [ n(NO)- 0.1 mol]×3+ n(NO2)×1= ![]() ×2
×2
解得:n(NO)= 0.8 mol n(NO2)= 0.3 mol
V(NO):V(NO2)= n(NO): n(NO2)= 0.8 mol: 0.3 mol=8:3
【解析】
试题分析:(1)①分析通过装置知该电解装置左室为电解池的阴极,电极反应式为2H2O + 2e-== H2↑ + 2OH-,右室为电解池的阳极,NO2气体发生氧化反应生成硝酸,电极反应式为NO2-e-+H2O = NO+2H+。
②根据阴、阳两极的电极反应式知若有标准状况下2.24 LNO2被吸收,转移电子0.1mol,阴极区生成的氢氧根为0.1mol,为维持电荷守恒通过阳离子交换膜的H+为0.1mol。
(2)①根据公式c=计算密度为1.4 g·mL-1、质量分数为63%的浓硝酸的物质的量浓度为1000×1.4 g·mL-1×63%/63 g·mol-1=14 mol/L。根据稀释定律c1V1=c2V2计算所需浓硝酸的体积为10 L ×0.2 mol·L-1/14 mol·L-1=0.1429L=142.9mL;
②根据题意知电解池的阴极电极反应式为2H2O + 2e-== H2↑ + 2OH-,电解池的阳极电极反应式为NO2-e-+H2O = NO+2H+、NO-e-+H2O = HNO2+H+ 、NO-3e-+2H2O = NO+4H+。根据原子守恒和电荷守恒作答。根据原子守恒:n(NO)+ n(NO2)=3 mol- 0.2 mol/L×10 L+0.1 mol =1.1 mol,根据电子守恒:0.1 mol×1+ [ n(NO)- 0.1 mol]×3+ n(NO2)×1= ![]() ×2,解得:n(NO)= 0.8 mol n(NO2)= 0.3 mol,V(NO):V(NO2)= n(NO): n(NO2)= 0.8 mol: 0.3 mol=8:3
×2,解得:n(NO)= 0.8 mol n(NO2)= 0.3 mol,V(NO):V(NO2)= n(NO): n(NO2)= 0.8 mol: 0.3 mol=8:3


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】某校高一学生学完胶体后,在老师的指导下,有甲、乙、丙三名同学分别进行Fe(OH)3 胶体的制备实验。
甲同学向 1 mol·L-1氯化铁溶液中加入少量的NaOH 溶液; 乙同学直接加热饱和FeCl3 溶液;
丙同学向 25 mL 沸水中逐滴加入 1 mL~2 mL FeCl3 饱和溶液,继续煮沸至溶液呈红褐色, 停止加热。试回答下列问题:
(1)其中操作正确的同学是________;若丙同学实验中不停止加热,会看到 __________。
(2)丁同学利用所制得的Fe(OH)3 胶体进行下列实验:
①将其装入 U 形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明___。
②向其中逐滴加入稀硫酸至过量,观察到的实验现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成纤维Z的吸湿性接近于棉花。合成Z的流程图如下所示: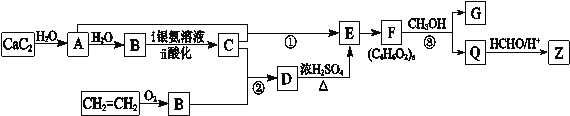
已知:下列反应中R、R′、R″代表烃基
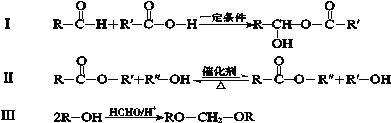
(1)A的结构简式是 。
(2)B的分子式为C2H4O,其官能团的名称是 。
(3)反应①的化学方程式是 。
(4)下列说法正确的是 。(填字母)
a.D→E的反应类型为消去反应 b.D能与Na、NaOH、NaHCO3反应
c.Q分子中含有—OH d.G在酸性或碱性环境中均能水解
(5)E有多种同分异构体,与E具有相同官能团的有 种(含顺反异构体,不包括E),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是 。
(6)合成纤维Z含有六元环状结构,Z的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。

(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组om] | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等 B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等 D.容器中气体的平均相对分子质量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钦(TiO2)表面作用使海水分解得到氢气的新技术:![]() 。制得的氢气可用于燃料电池。试回答下列问题:
。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水光解产物应用于燃料电池的整个过程中完成了能量的转化:____能转变为____能,最后转化 为_______能。
(2)水分解时,断裂的化学键为_____键(填“共价”或“离子”),分解海水的反应属于____反应(填“放热”或“吸热”)。
(3)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:2H2+2O2—4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的____极;电子从该极____(填“流入”或“流出”)。
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。该原电池的负极材料是_____,正极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,为实现变废为宝,设计了以下工艺流程制备七水硫酸镁。

在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为_____________________________;
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、SO42-、Cl-,为了除去H+,最好加入适量的_____________________________ (填化学式)。
(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸汽并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠____________ (“大”或“小”)。 结晶槽中硫酸镁结晶的方法为_______________。
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法错误的是
A.pH=3的 NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等
B.25℃时将0.1mol·L -1 的HF加水不断稀释,![]() 不变
不变
C.K2SO3溶液中加入少量NaOH固体,溶液的pH增大,SO32-水解程度减小
D.pH=5的CH3 COOH 与CH3COONa混合溶液中,c(CH3COO-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子最外层电子数是内层电子总数的1/5。下列说法中正确的是
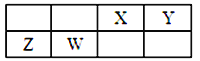
A. 原子半径由小到大的顺序为:X<Z<Y<W
B. Y元素最高价氧化物对应的水化物化学式为H3YO4
C. X、Z两种元素的氧化物中所含化学键类型相同
D. Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):

(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为 (用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a= ,b= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com