
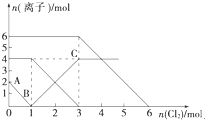
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 气态氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 一种核素质量数为27,中子数为14 |
| Z | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| W | 与Y同周期,在该周期主族元素中第一电离能最大 |
| T | 一种氧化物是生产防锈漆的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点 | 沸点 | 密度 | 水中溶解性 |
| 甲 | -98℃ | 57.7℃ | 0.93g?cm-3 | 可溶 |
| 乙 | -84℃ | 97℃ | 0.90g?cm-3 | 可溶 |
| A、萃取法 | B、过滤法 |
| C、蒸馏法 | D、分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4在医学上用做钡餐,是因为Ba2+没有毒 |
| B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C、14C可用于文物的年代鉴定,14C与12C互为同分异构体 |
| D、NO2在光照下能使O2经过复杂的反应生成O3,所以氮氧化物不会破坏臭氧层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气通过灼热的CuO粉末 |
| B、二氧化碳通过Na2O2粉末 |
| C、将锌粒投入Cu(NO3)2溶液 |
| D、碳酸氢钠固体加热至没有气体放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com