
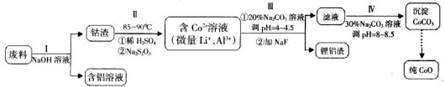
2- 3 |
2- 4 |
| 225 |
| 241 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 该元素的一种核素无中子 |
| Y | 单质在氧气中燃烧产物是造成酸雨的罪魁祸首之一 |
| Z | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| L | 与Y同周期,比Y原子半径小 |
| M | +3价离子3d能级为半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解、过滤、蒸发、结晶 |
| B、溶解、洗涤、过滤、干燥 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
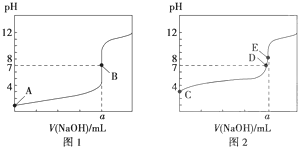
| A、滴定盐酸的曲线是图2 |
| B、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
| C、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-) |
| D、当0mL<V(NaOH)<20.00mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
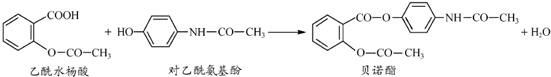
| A、贝诺酯分子中所有碳原子一定共平面 |
| B、可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D、乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
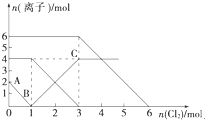 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 |
| B、碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污 |
| C、氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 |
| D、铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 1mol | 2NA | |
| B | 22.4L | 1mol | |
| C | 106g | 1mol | |
| D | 106g | 2 NA |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、方案甲:试液
| ||||
B、方案乙:试液
| ||||
C、方案丙:试液
| ||||
D、方案丁:试液
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com