
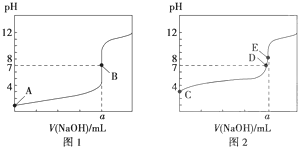
| A、滴定盐酸的曲线是图2 |
| B、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
| C、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-) |
| D、当0mL<V(NaOH)<20.00mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-) |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质M的晶体是体心立方堆积,M的配位数是8 |
| B、XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 |
| C、X的氢化物X2H2分子中含有2个σ键和2个π键 |
| D、由元素X与Z形成的化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④ |
| C、①②③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点 | 沸点 | 密度 | 水中溶解性 |
| 甲 | -98℃ | 57.7℃ | 0.93g?cm-3 | 可溶 |
| 乙 | -84℃ | 97℃ | 0.90g?cm-3 | 可溶 |
| A、萃取法 | B、过滤法 |
| C、蒸馏法 | D、分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4在医学上用做钡餐,是因为Ba2+没有毒 |
| B、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C、14C可用于文物的年代鉴定,14C与12C互为同分异构体 |
| D、NO2在光照下能使O2经过复杂的反应生成O3,所以氮氧化物不会破坏臭氧层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使淀粉碘化钾试纸变蓝的溶液中:K+、Ba2+、S2-、Cl- | ||
| B、FeCl3溶液中:K+、Na+、SO42-、AlO2- | ||
C、常温下,
| ||
| D、常温下由水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO3-、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com