
| 元素 | 相关信息 |
| X | 该元素的一种核素无中子 |
| Y | 单质在氧气中燃烧产物是造成酸雨的罪魁祸首之一 |
| Z | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| L | 与Y同周期,比Y原子半径小 |
| M | +3价离子3d能级为半充满 |
| ||
| ||
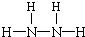 ;
;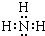 ,
,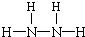 ;
;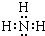 ;
;

科目:高中化学 来源: 题型:
| A、氧化钙,洁净的雨水 |
| B、氢氧化钾,含铜80%的氧化铜 |
| C、澄清的石灰水,粗盐 |
| D、红磷,空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
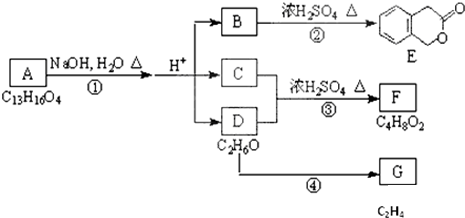
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
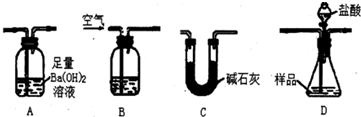
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 气态氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 一种核素质量数为27,中子数为14 |
| Z | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| W | 与Y同周期,在该周期主族元素中第一电离能最大 |
| T | 一种氧化物是生产防锈漆的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质M的晶体是体心立方堆积,M的配位数是8 |
| B、XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 |
| C、X的氢化物X2H2分子中含有2个σ键和2个π键 |
| D、由元素X与Z形成的化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
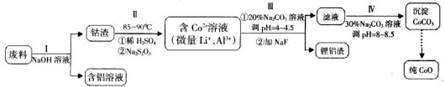
2- 3 |
2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com