
| 0.3mol |
| 6 |
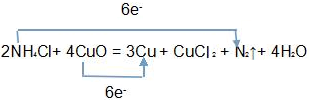 ,
,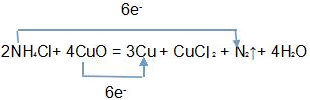 ;
;| 0.3mol |
| 6 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
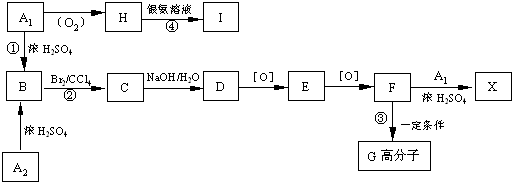
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离程度先增大,后又减小 |
| B、c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| C、溶液导电性先增强后减弱 |
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3; Fe2O3 |
| B、Fe(OH)2; FeO |
| C、Fe(OH)3、Fe(OH)2;Fe3O4 |
| D、Fe2O3;Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加快化石燃料的开采和使用 |
| B、NaHCO3可用于治疗胃酸过多 |
| C、明矾可用于水的杀菌消毒 |
| D、从海水中提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、化学反应速率关系是:3υ正(H2)=2υ正(NH3) |
| C、达平衡后,分离出少量NH3,V正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com