
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【答案】A
【解析】
A.HClO为弱酸,不能完全电离;
B.电解饱和食盐水生成氢气、氯气和氢氧化钠;
C.氯气具有强氧化性,可氧化氨气生成氮气;
D.氯气与亚硫酸钠发生氧化还原反应生成硫酸根离子。
A. HClO为弱酸,不能完全电离,离子方程式为Cl2 + H2O![]() H+ + Cl-+ HClO,A项错误;
H+ + Cl-+ HClO,A项错误;
B. 电解饱和食盐水生成氢气、氯气和氢氧化钠,电解方程式为2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑,B项正确;
2OH-+ H2↑+Cl2↑,B项正确;
C. 氯气具有强氧化性,可氧化氨气生成氮气,同时生成氯化铵,方程式为8NH3 + 3Cl2 === 6NH4Cl + N2,C项正确;。
D. 氯气与亚硫酸钠发生氧化还原反应生成硫酸根离子,反应的离子方程式为HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-,D项正确;
答案选A。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
![]()
![]()
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
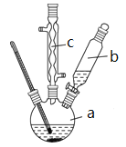
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称及作用是______________。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是______________。下列仪器中可用于分离苯乙酸粗品的是__________ (填编号)。
A.分液漏斗B.漏斗C.烧杯D.直形冷凝管E.玻璃棒
(3)提纯粗苯乙酸的方法是___________________。
(4)用CuCl22H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是_______________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
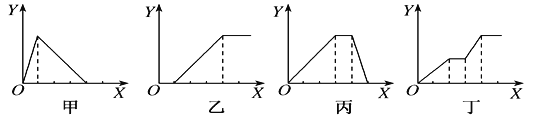
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
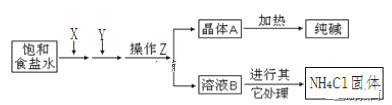
(1)在饱和食盐水中通入X和Y,则X____(填物质名称)
(2)写出通入X和Y的化学反应方程式_____。
(3)操作Z____(填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____,作用二____。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___、烘干、冷却、称量、烘干、冷却、___,最终得到固体bg。样品中纯碱的质量分数为____(用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____,然后_____,加热_____后,再____,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的浓硝酸与足量铜在烧杯中充分反应,产生NO2、N2O4和NO的混合气体,这些气体若与1.12LO2(标准状况)混合后通入水中,则气体被水完全吸收。若继续向烧杯中加入5mol·L-1H2SO4溶液100mL,剩余的铜恰好被溶解,则Cu的总质量为( )
A.9.6gB.19.2gC.24gD.25.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。
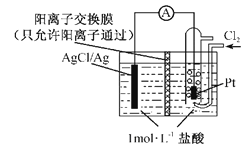
①正极反应为_________。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少______mol离子。
(2)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
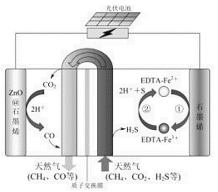
该装置工作时,阴极的电极反应:_________;协同转化总反应:___________;若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为_______性(碱性、中性、酸性)
(3)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池正极极增重______g。
(4)电化学降解法可用于处理酸性硝酸盐污水,设计一电解池(如图所示)。 若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为____g。
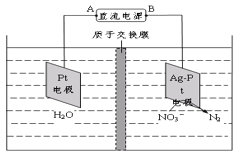
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和![]() 性质实验(夹持装置已省略)
性质实验(夹持装置已省略)
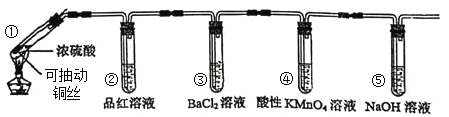
下列说法错误的是
A.反应后,试管①中出现白色固体,将其放入水中溶液显蓝色
B.试管②中品红溶液逐渐褪色,对其加热溶液又恢复红色
C.试管④中酸性高锰酸钾溶液褪色,体现了![]() 的漂白性
的漂白性
D.试管⑤可以改为装有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
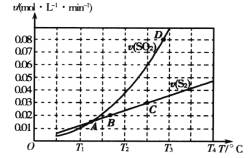
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求将相应序号填入空白中:
A.O2和O3
B.35Cl和37Cl
C.CH3CH2CH3和CH3CH2CH2CH3
D.H2和D2
E.CH3CH2CH2OH和CH3-O-CH2CH3
F.![]() C和
C和![]() N
N
(1)组两种微粒互为同位素___;
(2)组两种物质互为同素异形体___;
(3)组两种物质属于同系物___;
(4)组两物质互为同分异构体___;
(5)组两物质是同一物质___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com