
【题目】根据物质转化的框图答题:

(1)按官能团分类,X所属类别是_________________________。
(2)反应①所属反应类型为___________________________。
(3)写出反应①、②的化学反应方程式:①______________________;②_____________。
(4)有机物Y核磁共振氢谱显示有两组峰,其结构简式为_______________。
(5)已知:乙烯和1,3—丁二烯在催化剂作用下可发生反应:![]() 。现以X和1,3-丁二烯为原料在催化剂作用下反应,生成的有机物的结构简式为(用键线式表示)_______________。
。现以X和1,3-丁二烯为原料在催化剂作用下反应,生成的有机物的结构简式为(用键线式表示)_______________。
【答案】烯烃加成反应![]()
![]()
![]()
【解析】
根据转化关系可知,X(C3H6)→1,2-二溴丙烷,说明X为烯烃,结构简式为CH3-CH=CH2,该有机物发生加聚反应生成高分子,结构简式为:![]() ;X与氯化氢发生加成反应生成氯代烃Y;可能的结构有:CH2Cl-CH2-CH3 或CH3-CHCl -CH3;据以上分析解答该题。
;X与氯化氢发生加成反应生成氯代烃Y;可能的结构有:CH2Cl-CH2-CH3 或CH3-CHCl -CH3;据以上分析解答该题。
根据转化关系可知,X(C3H6)→1,2-二溴丙烷,说明X为烯烃,结构简式为CH3-CH=CH2,该有机物发生加聚反应生成高分子,结构简式为:![]() ;X与氯化氢发生加成反应生成氯代烃Y;可能的结构有:CH2Cl-CH2-CH3 或CH3-CH Cl -CH3;
;X与氯化氢发生加成反应生成氯代烃Y;可能的结构有:CH2Cl-CH2-CH3 或CH3-CH Cl -CH3;
(1)据以上分析可知,有机物X(C3H6)的结构简式为CH3-CH=CH2,含有碳碳双键,按官能团分类,X属于烯烃;综上所述,本题答案是:烯烃。
(2)据以上分析可知,X 为CH3-CH=CH2与溴发生加成反应生成1,2-二溴丙烷,所以反应①所属反应类型为加成反应;综上所述,本题答案是:加成反应。
(3)据以上分析可知,反应①为CH3-CH=CH2与溴发生加成反应,方程式为:![]() ;
;
反应②为CH3-CH=CH2发生加聚反应生成高分子,化学反应方程式:![]() ;
;
综上所述,本题答案是: ![]() ;
; ![]() 。
。
(4)CH3-CH=CH2与氯化氢发生加成反应,生成有机物Y核磁共振氢谱显示有两组峰,其结构简式为:![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
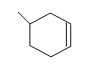
(5)根据乙烯和1,3—丁二烯在催化剂作用下可发生反应: ![]() 信息可知,CH3-CH=CH2与1,3-丁二烯发生加成反应,生成环状烯烃,生成的有机物的结构简式为:
信息可知,CH3-CH=CH2与1,3-丁二烯发生加成反应,生成环状烯烃,生成的有机物的结构简式为: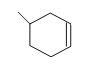 ;综上所,本题答案是:
;综上所,本题答案是: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的说法不正确的是
A.天然气的主要成份是乙烯
B.芳香烃主要来自于煤干馏后的煤焦油
C.汽油、煤油、柴油主要来自于石油的常压蒸馏
D.乙烯是石油裂解后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是( )

A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 22.4 L
D. 若将电池两极所通气体互换,X、Y两极材料也要互换。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业上,为了提高镀锌的效果,通常采用Zn(CN)42-溶液代替Zn2+溶液进行电解。请回答下列问题:
(1)元素锌在周期表中的位置为_____________,基态Zn的价电子排布式为_____________。
(2)Zn(CN) 42-所含元素中,电负性最大的元素是_____________,Zn(CN) 42-中含有的化学键类型有σ键和_____________。
(3)CN-中C的杂化类型为_____________,与CN-互为等电子体的单质为_____________。
(4)H2CO3与HNO3的酸性相差较大,请解释其原因_____________。
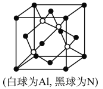
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为_____________,其晶体结构如图,已知晶胞边长为apm,则AlN的密度为_____________(用含a、NA的代数式表示)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯法合成氨技术的相关反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-93kJ/mol
2NH3(g) △H=-93kJ/mol
(1)试根据表中所列键能数据计算a的数值为_____________。

(2)在600℃下,向2L密闭容器中充入一定量的反应物并开始上述反应,图表示N2的物质的量随时间的变化曲线。
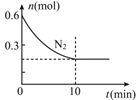
用H2表示0~10min内该反应的平均速率v(H2)= _____________,若该温度下K=0.0016L2/mol2,则在10min时c(H2)= _____________。
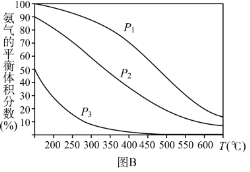
(3)在哈伯合成法中,平衡时NH3的体积分数与反应体系的压强(P)、温度(T)的关系如图B。则P1_____________P2(选填¨大于”、“小于”或¨不能确定”),其他条件相同,不同压强下在刚开始反应时反应物活化分子浓度较大的是_____________(选填“P1”、“P2”、“P3”或“不能确定”),在日本的合成氨工业中,选择合成温度为700℃的较高温,试从化学动力学的角度分析其理由是_____________。
(4)研究表明,合成氨的速率与相关物质的浓度的关系为v=kc(N2)c(H2)3/2c(NH3)-1,k为速率常数。能使合成氨的速率增大的措施是_____________。
A.使用更有效的催化剂
B.总压强一定,增大n(N2 )/n(H2)的值
C.升高反应温度
D.按照原来比值增大反应物的浓度
E.将原容器中NH3及时分离出来
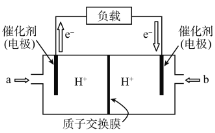
(5)如图是利用NH3催化氧化释放出电能的电池结构示意图(氧化产物为无污染性气体),放电时O2应从_____________(填“a”或“b”)处通入,该电池负极的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择下列某种答案的字母序号,填入下表的空格。
A.同位素 B.同系物 C.同分异构体 D.同种物质
① | ② | ③ | ④ | |
物质 |
| 16O与18O | 苯与对二甲苯 | 1—丁炔与1,3-丁二烯 |
相互关系 | _______ | _______ | _______ | _______ |
(2)按要求表达下列有机物
①乙烯的电子式:__________________;②2—甲基丙烷的结构简式:________________;
③1,2—二溴乙烷的结构简式:______________;④顺-2-戊烯的结构简式:_________;
⑤分子式为C6H12,核磁共振氢谱显示只有一组吸收峰的烯烃的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是
A. 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B. 该反应在任何条件下都能自发进行
C. 再加入一定量氨基甲酸铵,可加快反应速率
D. 保持温度不变,压缩体积,NH3的浓度不变时,就达到了新的平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同条件下利用N2+3H2![]() 2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是
2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是
A. v(H2)=0.1 mol·(L·min)1 B. v(N2)=0.01 mol·(L·s)1
C. v(N2)=0.2 mol·(L·min)1 D. v(NH3)=0.3 mol·(L·min)1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com