
����Ŀ�������Ƶ��ܱ���������м���һ���������İ�������粒���(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g) ��H>0������˵������ȷ����
2NH3(g)��CO2(g) ��H>0������˵������ȷ����
A. �ܱ������������ƽ����Է�������������÷�Ӧ�ﵽƽ��״̬
B. �÷�Ӧ���κ������¶����Է�����
C. �ټ���һ������������泥��ɼӿ췴Ӧ����
D. �����¶Ȳ��䣬ѹ�������NH3��Ũ�Ȳ���ʱ���ʹﵽ���µ�ƽ��
���𰸡�D
��������
���ɵ���������ʵ���֮��ʼ����2��1�������ƽ����Է�������ʼ�ղ��䣻����H-T��S<0�����Է����У��ı�������ʵ����Ի�ѧ��Ӧ����û��Ӱ�죻������ѹ�������ƽ�������ƶ�������ϵ��������������ʵ���֮��ʼ�ղ��䣬����������������䡣
��ӦNH2COONH4��s���T2NH3��g��+CO2��g�������ɵ���������ʵ���֮��ʼ����2��1�����������ƽ����Է�������ʼ�ղ��䣬�ʲ�����Ϊƽ��״̬���ж����ݣ���A���÷�Ӧ��H>0����S>0�����������£�H-T��S<0�������Է����У�B���������ʵĶ��ٶԻ�ѧ��Ӧ����û��Ӱ�죬C��������ѹ�������ƽ�������ƶ�������ϵ��������������ʵ���֮��ʼ�ղ��䣬������������������䣬D����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ����ˮ�Ȳ����������ֲ�����ԭ������
A.SO3+H2O��H2SO4B.Cl2+H2O��HCl+HClO
C.2F2+2H2O��4HF+O2D.2Na+2H2O��2NaOH+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ�Ƴ���ĺ������Է�ˮ�У����Ĵ�����ʽ��Cr(��)��Cr(��)���֣�������Cr(��)�Ķ������ⷨ����������ˮ��ͼ����������Cr(OH)3������ȥ������˵����ȷ����
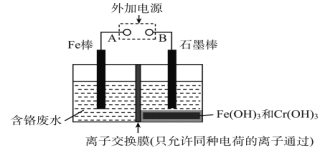
A. FeΪ��������ӦΪFe��2e��=Fe2+
B. ������ӦΪCr2O72��+7H2O+6e��=2Cr(OH)3��+8OH��
C. ����ÿת��3mol���ӣ��ɴ���Cr(��)���ʵ���Ϊ1mol
D. ���ӽ���ĤΪ���ӽ���Ĥ��ֻ����H+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת���Ŀ�ͼ���⣺

��1���������ŷ��࣬X���������_________________________��
��2����Ӧ��������Ӧ����Ϊ___________________________��
��3��д����Ӧ�١��ڵĻ�ѧ��Ӧ����ʽ����______________________����_____________��
��4���л���Y�˴Ź���������ʾ������壬��ṹ��ʽΪ_______________��
��5����֪����ϩ��1,3������ϩ�ڴ��������¿ɷ�����Ӧ��![]() ������X��1,3������ϩΪԭ���ڴ��������·�Ӧ�����ɵ��л���Ľṹ��ʽΪ���ü���ʽ��ʾ��_______________��
������X��1,3������ϩΪԭ���ڴ��������·�Ӧ�����ɵ��л���Ľṹ��ʽΪ���ü���ʽ��ʾ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
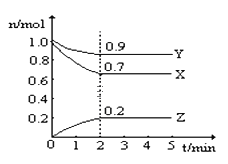
��1���÷�Ӧ�Ļ�ѧ����ʽΪ _______________________��
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ ___________��
��3��ij̽����ѧϰС������ͬ������п����ͬŨ�ȵ�������ϡ���ᷴӦ�õ�ʵ���������±���ʾ��
ʵ���� | п��״̬ | ��Ӧ�¶�/�� | �ռ�100mL��������ʱ��/s |
�� | ��Ƭ | 15 | 200 |
�� | ��Ƭ | 25 | 90 |
�� | ��ĩ | 25 | 10 |
�ٸ�ʵ���Ŀ����̽�� ______ �� ______ ��п��ϡ���ᷴӦ���ʵ�Ӱ�죻
��ʵ���͢���� ________________________________ ����ѧ��Ӧ����Խ��
���ܱ�������ı�����Է�Ӧ������Ӱ���ʵ������ ______ �� ______��
�������һ��ʵ�鷽��֤�������Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ�죺 ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽⷴӦ�Ĵ�Ч�����ס�����λͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣���������в���ȷ����
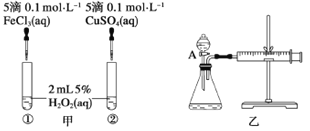
A. ͼ����ʾʵ���ͨ���۲�������ݵĿ������ȽϷ�Ӧ���ʵĴ�С
B. ��ͼ��ʵ���з�Ӧ����Ϊ�٣��ڣ���һ��˵��Fe3+��Cu2+��H2O2�ֽ��Ч����
C. ��ͼ����ʾװ�òⶨ��Ӧ���ʣ��ɲⶨ��Ӧ�����������������Ӧʱ��
D. Ϊ���ͼ����ʾװ�õ������ԣ��ɹر�A����������ע������������һ�����룬һ��ʱ����ɿ��������۲�����Ƿ�ص�ԭλ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѡ���Դ���ԭ��(SCR)��������������һ�ֳ����NOx���ƴ�����������Ҫ��Ӧ���£�
��4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ��H1=akJ��mol-1
4N2(g)+6H2O(g) ��H1=akJ��mol-1
��4NH3(g)+2NO2(g)+O2(g)![]() 3N2(g)+6H2O(g) ��H2=bkJ��mol-1
3N2(g)+6H2O(g) ��H2=bkJ��mol-1
����Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H4=dkJ��mol-1
4NO(g)+6H2O(g) ��H4=dkJ��mol-1
���Լ������Ӧ2NO(g)+O2(g)![]() 2NO2(g)�ġ�HΪ�� ��
2NO2(g)�ġ�HΪ�� ��
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ�к��еIJ�������Ũ�ȴ�С��ͼ��ʾ������Һ���ܻ�����Fe2+��Ba2+��H+��SO42-��CO32-��Ϊ�˽�һ��ȷ�ϣ��Ը���Һ����ʵ���⣺

����һ����ϸ�۲죬����Һ����ɫ��������һ״̬��
���������������BaCl2��Һ������23.3g ��ɫ�������ټ�ϡ����,��������ʧ��
��1��ԭ��Һ�г���ͼ�е��������⣬�϶������е�������________,�϶������е�������________��
��2��ʵ������IJ�����г�������ǰ��ʵ����������У����ˡ�ϴ�ӡ�______________�����������ϴ�ɾ��ķ�����____________��
��3��ԭ��Һ��H+���ʵ���Ũ��Ϊ_________mol/L��
��4����ԭ��Һ�м���NaHCO3��Һ����Ӧ�����ӷ���ʽΪ_____________��
��5������100 mLԭ��Һ�м���1mo/L ��Ba(OH)2��Һ�������ɵij��������պ����ʱ��������Ba(OH)2��Һ���Ϊ_________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
I����֪ijЩ��ѧ���ļ�����������
��ѧ�� | C=O | C��O | C��H | H��H | O��H |
����/kJ��mol-1 | 745 | 351 | 415 | 436 | 462 |
��CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ��H = __________ kJ��mol-1
CH3OH(g) + H2O(g) ��H = __________ kJ��mol-1
II����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
��1���÷�Ӧ��ѧƽ�ⳣ������ʽK = __________��
��2����֪��ijѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ����ƽ��ʱCO2��ת������ͼ��ʾ��

�ٸ÷�Ӧ�Ħ�H __________ 0���>"��<������
�����¶Ȳ��䣬��С��ӦͶ�ϱ�[n(H2)/n(CO2)]��Kֵ��____������������������С����������������
��3��ij�¶��£������һ�����ܱ�������ͨ��CO2(g)��H2(g)����������Ӧ���������������ٷ����仯ʱ����˵����Ӧ�ﵽƽ��״̬����__________��
A��������̼��Ũ�� B�������е�ѹǿ
C��������ܶ� D��CH3OCH3��H2O�����ʵ���֮��
��4��ij�¶��£�������ɱ���ܱ������У��ı���ʼʱ��������ʵ������ڲ�ͬ��ѹǿ�£�ƽ��ʱCH3OCH3(g)�����ʵ������±���ʾ��
P1 | P2 | P3 | |
I��2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II��1.0 mol CO22 | X1 | Y1 | Z1 |
III��1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
��P1 __________ P3���>����<����=������
��P2�£�III��CH3OCH3��ƽ��ת����Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com