
����Ŀ���ڵ�Ƴ���ĺ������Է�ˮ�У����Ĵ�����ʽ��Cr(��)��Cr(��)���֣�������Cr(��)�Ķ������ⷨ����������ˮ��ͼ����������Cr(OH)3������ȥ������˵����ȷ����
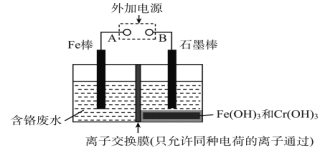
A. FeΪ��������ӦΪFe��2e��=Fe2+
B. ������ӦΪCr2O72��+7H2O+6e��=2Cr(OH)3��+8OH��
C. ����ÿת��3mol���ӣ��ɴ���Cr(��)���ʵ���Ϊ1mol
D. ���ӽ���ĤΪ���ӽ���Ĥ��ֻ����H+����
���𰸡�A
��������
��ⷨ����������ˮ��ԭ���������������������ڵ���������������������������Ӧ�����������ӣ������������£��������ӽ����۸����ӻ�ԭ�����۸����ӣ��������ӱ�������������������ͬʱ����������ˮ�ŵ�������������OH-��OH-����Һ��Cr3+��Fe3+��Ӧ�γ�������������������ﵽ��ˮ������Ŀ�ġ�
A��ڵ���������������������������Ӧ�����������ӣ��缫��ӦʽΪFe��2e��=Fe2+����A��ȷ��
B�Cr2O72������������Fe2+��ԭΪCr3+��������ˮ�ŵ�ŵ�������������OH-���缫��ӦʽΪ2H2O+2e��= H2��+2 OH������B����
C�����ÿת��3mol���ӣ���1.5mol Fe2+���ɣ������ӷ���ʽCr2O72-+6Fe2++14H+=2Cr3+
+7H2O+6Fe3+��֪��1.5mol Fe2+��ԭ0.25molCr2O72-�����ɴ���Cr(��)���ʵ���Ϊ0.5mol����C����
D�Cr2O72������������Fe2+��Ӧ����Cr3+��Fe3+��������ˮ�ŵ�������������OH-��Cr3+��Fe3+ͨ�������ӽ���Ĥ��������������OH-��Ӧ����������������������ӽ���Ĥ�������ӽ���Ĥ���������ӽ���Ĥ����D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K����NH4����Fe2����Al3����Cl����SO42����CO32����AlO2�� �е�����������������Ũ�Ⱦ�Ϊ0.1 mol��L��1��ijͬѧ����������ʵ�飬����˵����ȷ����
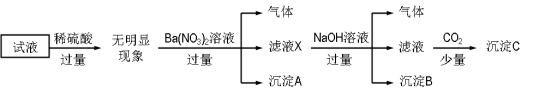
A����ȷ��ԭ��Һ���Ƿ���Al3����Cl��
B����ҺX�д������ڵ���������NH4����Fe2����Ba2��
C����ȷ������C�ijɷ�
D��ԭ��Һ�д��ڵ�����ΪNH4����Fe2����Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ʮ�Ŵ�ָ�����ӿ�ˮ��Ⱦ���Ρ�ʵʩ�����ͽ��������ۺ�������������Ⱦ�������ǻ�ѧ�������о�����Ҫ���⣬Ҳ�Ǽ��С���ˮ��ɽ���ǽ�ɽ��ɽ������Ҫ�ٴ롣���ʵ��������£���CO2ת��Ϊ�״������ѵ��л���ȿɽ���CO2��ɵ�����ЧӦ�Ի�����Ӱ�죬���ɵõ���Ҫ���л����
(1)��֪����2H2(g)+O2(g)=2H2O(g) ��H1=484 kJ/mol
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H2=50 kJ/mol
CH3OH(g)+H2O(g) ��H2=50 kJ/mol
��2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ��H����H=_____________��
(2)��֪T Kʱ��ij�����ܱ������д������·�Ӧ��2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ��H<0����������в�ͬʱ��ʱ�����ʵ�Ũ��(mol/L)���±���ʾ��
CH3OCH3(g)+3H2O(g) ��H<0����������в�ͬʱ��ʱ�����ʵ�Ũ��(mol/L)���±���ʾ��
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
��ʼʱ | a | b | 0 | 0 |
10 sʱ | 3 | 0.5 | c | 1.5 |
������Ӧ��ʼ��10sʱ����ڣ�v(H2)=_____________��������߷�Ӧ���ʣ��������H2ת���ʵķ�����________________________��
����T Kʱ����ѧƽ�ⳣ��K=15����10 s ʱv(��)_______v(��)���>����<����=��������ʱCO2��ת����Ϊ________��
(3)һ�������£���ij�����ܱ������г���x mol CO2��y mol H2�������ķ�ӦΪCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=50 kJ��mol1��
CH3OH(g)+H2O(g) ��H=50 kJ��mol1��
����ͼ1���ܱ�ʾ�÷�Ӧ��ƽ�ⳣ��K���¶�T֮��ı仯��ϵ����Ϊ______���a����b���������ж�������__________________________________��
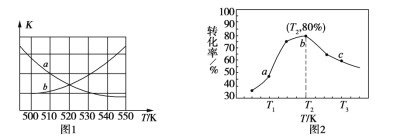
����x=2��y=3���������ͬʱ���ڲ�ͬ�¶���H2��ת������ͼ2��ʾ�����ڸ�ʱ����ڣ�ǡ�ôﵽ��ѧƽ��ʱ�������ڵ�ѹǿ�뷴Ӧ��ʼʱ��ѹǿ֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ� Fe(OH)2��װ����ͼ��ʾ�����е����������Ϸֱ�Ϊ����ʯī��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ������������˵����ȷ����( )

A. ʯī�缫�ĵ缫��ӦʽΪO2��4e��===2O2��
B. X�����缫
C. ��������1mol Fe�ܽ⣬ʯī���H2 22.4 L
D. �������������ͨ���廥����X��Y��������ҲҪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ������������������й㷺���ڡ�
��1�������ǽ�1mol�����������AB��Ϊ������̬ԭ��A��B�������������֪���л�ѧ���ļ������±���

д��1mol��̬��(H2N-NH2)ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ________________��
��2���ý�̿��ԭNO�ķ�ӦΪ��2NO(g)+C(s)![]() N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ���(��Ӧ�¶ȷֱ�Ϊ400�桢400�桢T��)�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��
N2(g)+CO2(g)�����ݻ���Ϊ1L�ļס��ҡ����������ݺ���(��Ӧ�¶ȷֱ�Ϊ400�桢400�桢T��)�����зֱ���������Ľ�̿��һ������NO����ø�������n(NO)�淴Ӧʱ��t�ı仯������±���ʾ��

�ٸ÷�ӦΪ________(����ȡ������ȡ�)��Ӧ��
����������60minʱ�ﵽƽ��״̬����0��60min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NO)=____________��
��3���ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
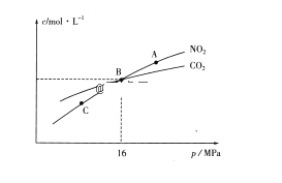
��A��C�����Ũ��ƽ�ⳣ����ϵ��Kc(A)________Kc(C)(�<����>����=��)��
��A��B��C������NO2��ת������ߵ���________(�A����B����C��)�㡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƹ�ҵ�ϣ�Ϊ����߶�п��Ч����ͨ������Zn(CN)42����Һ����Zn2+��Һ���е�⡣��ش��������⣺
(1)Ԫ��п�����ڱ��е�λ��Ϊ_____________����̬Zn�ļ۵����Ų�ʽΪ_____________��
(2)Zn(CN) 42������Ԫ���У��縺������Ԫ����_____________��Zn(CN) 42���к��еĻ�ѧ��������������_____________��
(3)CN����C���ӻ�����Ϊ_____________����CN����Ϊ�ȵ�����ĵ���Ϊ_____________��
(4)H2CO3��HNO3���������ϴ��������ԭ��_____________��
(5)N��Al�����һ�����Ͱ뵼�����AlN��AlN�������£���ĥ���ܡ��侧������Ϊ_____________���侧��ṹ��ͼ����֪�����߳�Ϊapm����AlN���ܶ�Ϊ_____________(�ú�a��NA�Ĵ���ʽ��ʾ)g/cm3��
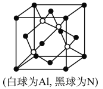
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ϳɰ���������ط�ӦΪ��N2(g)+3H2(g) ![]() 2NH3(g) ��H=��93kJ/mol
2NH3(g) ��H=��93kJ/mol
(1)�Ը��ݱ������м������ݼ���a����ֵΪ_____________��

(2)��600���£���2L�ܱ������г���һ�����ķ�Ӧ�ﲢ��ʼ������Ӧ��ͼ��ʾN2�����ʵ�����ʱ��ı仯���ߡ�
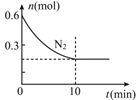
��H2��ʾ0~10min�ڸ÷�Ӧ��ƽ������v(H2)= _____________�������¶���K=0.0016L2/mol2������10minʱc(H2)= _____________��
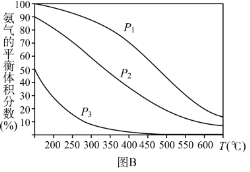
(3)�ڹ����ϳɷ��У�ƽ��ʱNH3����������뷴Ӧ��ϵ��ѹǿ(P)���¶�(T)�Ĺ�ϵ��ͼB����P1_____________P2(ѡ��������������С������������ȷ����)������������ͬ����ͬѹǿ���ڸտ�ʼ��Ӧʱ��Ӧ������Ũ�Ƚϴ����_____________(ѡ����P1������P2������P3����������ȷ����)�����ձ��ĺϳɰ���ҵ�У�ѡ��ϳ��¶�Ϊ700���Ľϸ��£��Դӻ�ѧ����ѧ�ĽǶȷ�����������_____________��
(4)�о��������ϳɰ���������������ʵ�Ũ�ȵĹ�ϵΪv=kc(N2)c(H2)3/2c(NH3)��1��kΪ���ʳ�������ʹ�ϳɰ�����������Ĵ�ʩ��_____________��
A.ʹ�ø���Ч�Ĵ���
B.��ѹǿһ��������n(N2 )/n(H2)��ֵ
C.���߷�Ӧ�¶�
D.����ԭ����ֵ����Ӧ���Ũ��
E.��ԭ������NH3��ʱ�������
(5)��ͼ������NH3�������ͷų����ܵĵ�ؽṹʾ��ͼ(��������Ϊ����Ⱦ������)���ŵ�ʱO2Ӧ��_____________(����a������b��)��ͨ�룬�õ�ظ����ĵ缫��ӦʽΪ_____________��
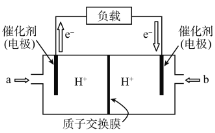
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƶ��ܱ���������м���һ���������İ�������粒���(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g) ��H>0������˵������ȷ����
2NH3(g)��CO2(g) ��H>0������˵������ȷ����
A. �ܱ������������ƽ����Է�������������÷�Ӧ�ﵽƽ��״̬
B. �÷�Ӧ���κ������¶����Է�����
C. �ټ���һ������������泥��ɼӿ췴Ӧ����
D. �����¶Ȳ��䣬ѹ�������NH3��Ũ�Ȳ���ʱ���ʹﵽ���µ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ��̶����ܱ������У����淴ӦH2(g)+I2(g) ![]() 2HI(g)�ﵽƽ��״̬�ı�־��
2HI(g)�ﵽƽ��״̬�ı�־��
A. ���������ܶȱ��ֲ���
B. H2��I2��HI�ķ�����֮��Ϊ1:1:2
C. �����ڻ���������ɫ���ٷ����仯
D. 1mol H��H�����ѵ�ͬʱ��2molH��I���γ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com