
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。
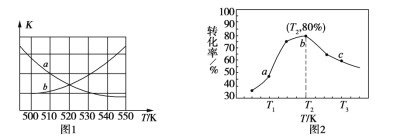
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
【答案】1352 kJ/mol0.3 mol/(L·s)加入过量的CO2>25%a该反应是放热反应,升高温度不利于平衡向右移动,平衡常数变小17︰25
【解析】
(1)3×①2×②得2CH3OH(g)+3O2(g)![]() 2CO2(g)+4H2O(g) ΔH=1352 kJ/mol,故答案为:1352 kJ/mol;
2CO2(g)+4H2O(g) ΔH=1352 kJ/mol,故答案为:1352 kJ/mol;
(2)①由方程式和表中数据知反应开始到10 s时,消耗H2的浓度为3 mol/L,故v(H2)=0.3 mol/(L·s);该容器恒容,则不可通过压缩体积的方法,而可以使用过量的CO2,既能提高反应速率,又能提高H2转化率;故答案为:0.3 mol/(L·s)、加入过量的CO2;
②由方程式知c=0.5,Q=![]() =12<K,反应仍在向右进行,v(正)>v(逆)。10 s时,消耗的c(CO2)=
=12<K,反应仍在向右进行,v(正)>v(逆)。10 s时,消耗的c(CO2)=![]() × 1.5 mol/L= 1 mol/L,a=4,故CO2的转化率=
× 1.5 mol/L= 1 mol/L,a=4,故CO2的转化率=![]() =25%,故答案为:>、 25%;
=25%,故答案为:>、 25%;
(3)①该反应是放热反应,升高温度不利于反应向右进行,会使平衡常数减小,曲线a符合此特点,故答案为:a ;该反应是放热反应,升高温度不利于平衡向右移动,平衡常数变小;
②由图知,当温度在T2时,H2的转化率最高。温度越高反应速率越大,在相同时间内达到平衡状态前,H2的转化率越高,但达到平衡状态后继续升温,则反应会向逆反应方向移动,导致H2的转化率降低,由图知b点为平衡态。则在此时有如下关系:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应初始量(mol) 2 3 0 0
变化量(mol) 0.8 3×80% 0.8 0.8
平衡态(mol) 1.2 0.6 0.8 0.8
同温同体积时压强比等于物质的量之比,故b点时对应的压强与反应开始时的压强之比=3.4︰5=17︰25,故答案为:17︰25。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关滴定操作的顺序正确的是( )
①检查滴定管是否漏水;
②用标准溶液润洗盛装标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
③用蒸馏水洗涤玻璃仪器;
④装标准溶液和待测液并调整液面(记录初读数);
⑤取一定体积的待测液于锥形瓶中;
⑥进行滴定操作
A.①③②④⑤⑥B.①②③④⑤⑥
C.②③①④⑤⑥D.④⑤①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是X__________,Y__________,Z__________,T__________,U__________
(2)Y原子的结构示意图为__________
(3)用电子式表示Y与T组成的化合物的形成过程:__________
(4) YX2和U2Y反应的化学方程式为_______________________,其中氧化剂是__________,被氧化的元素是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是
A. 便于运输、储存,从安全角度考虑,硅是最佳的燃料
B. 自然界的含硅化合物易开采
C. 硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制
D. 自然界中存在大量单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com