
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是X__________,Y__________,Z__________,T__________,U__________
(2)Y原子的结构示意图为__________
(3)用电子式表示Y与T组成的化合物的形成过程:__________
(4) YX2和U2Y反应的化学方程式为_______________________,其中氧化剂是__________,被氧化的元素是_______。
【答案】O S Cl Na H ![]()
![]() 2H2S+SO2=3S↓+2H2O SO2 硫
2H2S+SO2=3S↓+2H2O SO2 硫
【解析】
根据X、Y、Z三元素在周期表中的位置以及三元素的原子序数之和是41可知,若假设X的原子序数是a,则a+a+8+a+9=41,解得a=8,则X是氧元素,Y是硫元素,Z是氯元素;X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物,则T是钠元素,U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红,则U是氢元素;据此判断。
(1)根据以上分析可知X、Y、Z、T、U分别是O、S、Cl、Na、H。
(2)硫原子的结构示意图为![]() ;
;
(3)Y与T组成的化合物是离子化合物Na2S,则用电子式表示Y与T组成的化合物的形成过程为![]() ;
;
(4)SO2和H2S反应的化学方程式为2H2S+SO2=3S↓+2H2O,SO2中S元素化合价降低,是氧化剂,硫化氢中S元素化合价升高,则被氧化的元素是硫。


科目:高中化学 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:

实验(二)Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.20molL-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 22.40mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B____,仪器C____。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是____。
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需____;
(4)操作Ⅱ的步骤是:__、__、过滤、洗涤。
(5)还原剂A可用SO2,写出该反应的离子方程式____,此时后续处理的主要目的是____。
(6)滴定终点时现象为____;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为____;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )

A. a处通入氧气,b处通入氢气
B. 该装置中只涉及两种形式的能量转化
C. P一型半导体连接的是电池负极
D. 电池正极电极反应式为O2+2H2O+4e—=4OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 二氧化硫既有氧化性又有还原性,在空气中易被氧化为三氧化硫
B. 标准状况下,每摩尔三氧化硫的体积约为2.24 L
C. 二氧化硫和三氧化硫都是酸性氧化物
D. 二氧化硫具有漂白性,三氧化硫具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据参考消息网2017年4月8日报道,美国《大众科学》月刊网站发表了题为《石墨烯滤膜可能会让海水淡化更便宜》的报道。另据人民网2017年2月22日报道,目前中国首款石墨烯锂离子五号充电电池正式投入市场。根据要求回答问题:
(1)石墨烯是一种由碳原子形成的蜂窝状平面薄膜,是一种只有一个原子层厚度的准二维材料,所以又叫单原子层石墨。
①石墨烯的组成元素是______________________。
②石墨烯属于________(填序号)。
a.无机化合物 b.有机化合物 c.碳的同素异形体 d.烯烃
③一定条件下石墨烯与![]() 通过_________反应可得到石墨烷。
通过_________反应可得到石墨烷。
④石墨烯中碳原子与碳原子之间化学键类型是______________________。
(2)石墨烯滤膜很容易让水通过,而盐却不行,这种使海水淡化的方法叫石墨烯滤膜法,请写出海水淡化的其他方法:_________________________________(写1种即可)
(3)一种石墨烯锂硫电池的工作原理如图所示:

①该电池的正极是______________(填“a”或“b”)极,该电极上发生____________(填“氧化”或“还原”)反应。
②该电池的电解液中,![]() 的移动方向是_____________________________。
的移动方向是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)搅拌棒为何不用铜质的_____________.
(4)实验数据如下表:
①请填写下表中的空白:________。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是______。
A.滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。
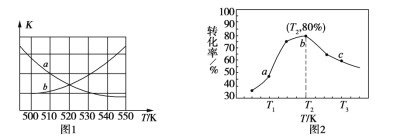
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景。 PPG的一种合成路线如下:

已知:①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;②化合物B为单氯代烃:化合物C的分子式为C5H8;③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④  。回答下列问题:
。回答下列问题:
(1)E的化学名称为 。
(2)H的结构简式为___________________。
(3)由D和H生成PPG的反应类型为______________。
(4)由A生成B的化学方程式为__________________________。
(5)由B生成C的化学方程式为__________________________。
(6)A的链状烃中同分异构体共有___________种,其中核磁共振氢谱显示为3组峰,且峰面积比为6:3:1的是 ___________ (写结构简式),A的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是________(填标号)。
a.元素分析仪 b.质谱仪 c.红外光谱仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列①~⑧中物质间的反应不能产生气体的是 ( )
①石灰石和盐酸 ②冷浓硫酸中投入铝片 ③石英与苏打混和加强热 ④石墨与高温水蒸气 ⑤过氧化钠与水 ⑥氟与水 ⑦钠与硫酸铜溶液 ⑧碳酸氢钠与氢氧化钠溶液
A.①和⑤B.④和⑦C.③和⑦D.②和⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com