
【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
【答案】橙色Cr2![]() +H2O
+H2O![]() 2Cr
2Cr![]() +2H+I2或碘4
+2H+I2或碘4![]() +O2+4H+=I2+2H2OD S2
+O2+4H+=I2+2H2OD S2![]() +2H+=S↓+SO2↑+H2O5H2C2O4+2Mn
+2H+=S↓+SO2↑+H2O5H2C2O4+2Mn![]() +6H+=2Mn2++10CO2↑+8H2O2mL确保每次实验c(H2C2O4) c(H2SO4)不变1.5
+6H+=2Mn2++10CO2↑+8H2O2mL确保每次实验c(H2C2O4) c(H2SO4)不变1.5![]() mol·
mol·![]() ·
·![]()
【解析】
(1)加入足量70%的硫酸,氢离子浓度增大,使化学平衡向正反应方向移动,所以溶液由黄色变为橙色;平衡体系的离子方程式为Cr2![]() +H2O
+H2O![]() 2Cr
2Cr![]() +2H+;(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察I2浓度变化比较速率快慢的,KI被氧化生成碘,反应的离子方程式为4
+2H+;(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察I2浓度变化比较速率快慢的,KI被氧化生成碘,反应的离子方程式为4![]() +O2+4H+=I2+2H2O;(3)根据反应浓度越大反应速率越快,反应温度越高反应速率越快,通过表格中数据可知下表各组实验中最快出现浑浊的是D;反应离子方程式为S2
+O2+4H+=I2+2H2O;(3)根据反应浓度越大反应速率越快,反应温度越高反应速率越快,通过表格中数据可知下表各组实验中最快出现浑浊的是D;反应离子方程式为S2![]() +2H+=S↓+SO2↑+H2O;(4)①根据实验试剂为草酸与高锰酸钾反应,故实验原理为:5H2C2O4+2Mn
+2H+=S↓+SO2↑+H2O;(4)①根据实验试剂为草酸与高锰酸钾反应,故实验原理为:5H2C2O4+2Mn![]() +6H+=2Mn2++10CO2↑+8H2O;②分析上述表中的实验数据。V=2mL.实验中加水的目的是确保每次实验c(H2C2O4) 、c(H2SO4)不变;③反应中消耗高锰酸钾的浓度是
+6H+=2Mn2++10CO2↑+8H2O;②分析上述表中的实验数据。V=2mL.实验中加水的目的是确保每次实验c(H2C2O4) 、c(H2SO4)不变;③反应中消耗高锰酸钾的浓度是![]() =0.06mol/L,所以υ(KMnO4)=
=0.06mol/L,所以υ(KMnO4)=![]() =1.5×10-2 mol / (L·min)。
=1.5×10-2 mol / (L·min)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 反应Fe+H2SO4![]() FeSO4+H2↑ 的能量变化如图所示:
FeSO4+H2↑ 的能量变化如图所示:

(1)该反应为__________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是__________;
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一电极材料,则铜为__________(填“正”或“负”)极。铜片上的现象为________________,该极上发生的电极反应为_______________;
II . 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线a,b,c如图所示。根据图中数据填空。

(1)该反应的化学方程式为______________;
(2)反应开始至2min,以气体Z表示的平均反应速率为_____________;
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_____________倍;
②达平衡时,容器内混合气体的平均相对分子质量和起始投料时相比__________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )

A. a处通入氧气,b处通入氢气
B. 该装置中只涉及两种形式的能量转化
C. P一型半导体连接的是电池负极
D. 电池正极电极反应式为O2+2H2O+4e—=4OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能达到预期目的的是
A.将苯和溴水混合后加入铁粉制取溴苯B.用金属钠区分乙醇和乙醚
C.用酸性高锰酸钾溶液除去乙炔中含有的 H2SD.将敞口久置的电石与饱和食盐水混合制乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 二氧化硫既有氧化性又有还原性,在空气中易被氧化为三氧化硫
B. 标准状况下,每摩尔三氧化硫的体积约为2.24 L
C. 二氧化硫和三氧化硫都是酸性氧化物
D. 二氧化硫具有漂白性,三氧化硫具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据参考消息网2017年4月8日报道,美国《大众科学》月刊网站发表了题为《石墨烯滤膜可能会让海水淡化更便宜》的报道。另据人民网2017年2月22日报道,目前中国首款石墨烯锂离子五号充电电池正式投入市场。根据要求回答问题:
(1)石墨烯是一种由碳原子形成的蜂窝状平面薄膜,是一种只有一个原子层厚度的准二维材料,所以又叫单原子层石墨。
①石墨烯的组成元素是______________________。
②石墨烯属于________(填序号)。
a.无机化合物 b.有机化合物 c.碳的同素异形体 d.烯烃
③一定条件下石墨烯与![]() 通过_________反应可得到石墨烷。
通过_________反应可得到石墨烷。
④石墨烯中碳原子与碳原子之间化学键类型是______________________。
(2)石墨烯滤膜很容易让水通过,而盐却不行,这种使海水淡化的方法叫石墨烯滤膜法,请写出海水淡化的其他方法:_________________________________(写1种即可)
(3)一种石墨烯锂硫电池的工作原理如图所示:

①该电池的正极是______________(填“a”或“b”)极,该电极上发生____________(填“氧化”或“还原”)反应。
②该电池的电解液中,![]() 的移动方向是_____________________________。
的移动方向是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。
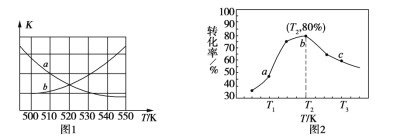
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
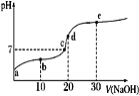
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com