
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
【答案】D
【解析】
物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),由表格数据可知4min达到平衡,平衡时n(SO2)=0.08mol,则
2SO2(g)+O2(g)2SO3(g)
开始(mol) 0.2 0.1 0
转化(mol) 0.12 0.06 0.12
平衡(mol) 0.08 0.04 0.12
据此分析解答。
A.根据表格数据,4~5min内,反应已达平衡状态,正、逆反应速率相等,故A正确;
B.过量氧气可促进二氧化硫的转化,则要提高SO3的产率,可鼓入过量空气,故B正确;
C.从反应开始到达到平衡,用SO3表示的平均反应速率为 =0.015 mol/(Lmin),故C正确;
=0.015 mol/(Lmin),故C正确;
D.同温相同体积时,气体的物质的量比等于压强之比,则容器内达到平衡状态时的压强与起始时的压强之比为(0.08+0.04+0.12)∶(0.2+0.1)=4∶5,故D错误;
答案选D。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
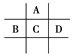
(1)A与E形成化合物的化学式是_____。
(2)B的最高价氧化物化学式为_______,C的元素名称为______,D的单质与水反应的方程式为_______。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现是____,有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:3H2+N2 ![]() 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
A. 3v(H2)正=v(N2)逆 B. v(H2)生成=v(NH3)生成
C. 2v(N2)消耗=v(NH3)消耗 D. 3v(H2)逆=2v(NH3)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4mol/L的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,则①原混合酸中c( H+)为________________。
②溶液中发生反应的离子方程式为_______。
③充分反应后最多可收集到标准状况下的气体的体积为__________,被还原硝酸的物质的量为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )
A. Zn、Al B. Fe、Zn C. Al、Mg D. Mg、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定操作的顺序正确的是( )
①检查滴定管是否漏水;
②用标准溶液润洗盛装标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
③用蒸馏水洗涤玻璃仪器;
④装标准溶液和待测液并调整液面(记录初读数);
⑤取一定体积的待测液于锥形瓶中;
⑥进行滴定操作
A.①③②④⑤⑥B.①②③④⑤⑥
C.②③①④⑤⑥D.④⑤①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率、化学平衡理论通过大量化学实验进行验证,回答下列相关实验问题。
(1)、Cr2![]() 在溶液中与
在溶液中与![]() 存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
存在一平衡体系,若向体系中加入足量70%的硫酸,溶液呈______色,平衡体系的离子方程式________________________。
(2)、探究酸性条件下影响KI溶液被空气氧化的快慢因素,通过观察___________浓度变化比较速率快慢的,KI被氧化的离子方程式___________________。
(3)根据硫代硫酸钠与酸反应探究多种条件对反应速率的影响,下表各组实验中最快出现浑浊的是______;反应离子方程式_________________________________.
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c/mol· | V/mL | c/mol· | V/mL | V/mL | ||
A | 0.1 | 5 | 0.5 | 5 | 10 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
(4)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/LH2C2O4溶液 | H2O | 0.2 mol/LKMnO4溶液 | 3 mol/L稀硫酸 | ||
1 | 3.0 | V | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
①根据实验试剂写出实验原理:_____________________(用离子方程式表示)
②分析上述表中的实验数据。V=___mL.实验中加水的目的是________________.
③利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com