
【题目】两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )
A. Zn、Al B. Fe、Zn C. Al、Mg D. Mg、Cu
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
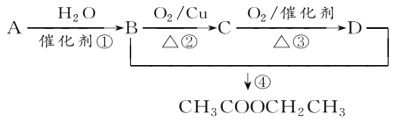
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是__________________、________________。
(3)写出下列反应的反应类型:①________,②________,④________。
(4)写出下列反应的化学方程式:
①_______________________________;
④_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行电解。通电一段时间后,发现湿润的淀粉-KI试纸的C端变为蓝色。
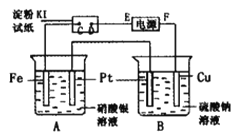
(1)E为电源的_________极F为电源的_________极
(2)A中发生反应的化学方程式为____________________________________。
(3)在B端观察到的现象是_____________________________________________。
(4)D端的电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用下图装置制取少量氮气。下列说法正确的是
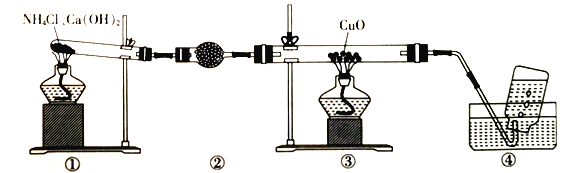
A. ②中盛放的是五氧化二磷
B. 实验开始时先点燃③的酒精灯,再点燃①的酒精灯
C. ③中玻璃管中的反应:2NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
D. 实验结束时先熄灭①、③的酒精灯,再将导管从水槽中拿出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是_________________。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是________ (填字母代号),作负极的物质发生了________反应(填“氧化”或“还原”)。
(3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题:

①下列说法正确的是________ (填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的酸性均减弱
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+B(g) ![]() 3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色透明溶液中:Ba2+、Mg2+、Cl-、![]()
B. 能使酚酞变红的溶液中:Ca2+、K+、![]() 、
、![]()
C. 0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、![]()
D. 与铝反应能放出氢气的溶液中:NH4+、Cu2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能达到预期目的的是
A.将苯和溴水混合后加入铁粉制取溴苯B.用金属钠区分乙醇和乙醚
C.用酸性高锰酸钾溶液除去乙炔中含有的 H2SD.将敞口久置的电石与饱和食盐水混合制乙炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com