
【题目】合成氨反应为:3H2+N2 ![]() 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
A. 3v(H2)正=v(N2)逆 B. v(H2)生成=v(NH3)生成
C. 2v(N2)消耗=v(NH3)消耗 D. 3v(H2)逆=2v(NH3)正
【答案】C
【解析】
反应达平衡时,v正=v逆,用不同物质表示同一化学反应速率,速率之比等于化学计量数之比。v(H2):v(N2):v(NH3)=3:1:2。
反应达平衡时,v正=v逆,用不同物质表示同一化学反应速率,速率之比等于化学计量数之比。v(H2):v(N2):v(NH3)=3:1:2。
A. 3v(H2)正=v(N2)逆,不能说明达到平衡状态,应为v(H2)正=3v(N2)逆,故A错误;
B. v(H2)生成=v(NH3)生成,虽然 v(H2)生成表示逆反应速率,v(NH3)生成表示正反应速率,但不符合比例关系,应为2v(H2)生成=3v(NH3)生成,故B错误;
C. 2v(N2)消耗=v(NH3)消耗,即v正=v逆,故C正确;
D. 3v(H2)逆=2v(NH3)正,不能说明达到平衡状态,应为2v(H2)逆=3v(NH3)正,故D错误。
故选C。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:

(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式:____________。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____mol·L-1·s-1。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A 压强不再变化 B υ(A)正=2υ(B)逆
C 气体密度不再变化 D A的百分含量保持不变
E A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”)其电极反应式为______。
(2)电子由_____极经外电路流向___极(填“Ag2O”或“Al”),当有 1mol电子流经外电路时,负极质量减少___g。
(3)溶液中的 OH-向____极迁移(填“Ag2O”或“Al”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行电解。通电一段时间后,发现湿润的淀粉-KI试纸的C端变为蓝色。
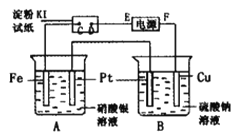
(1)E为电源的_________极F为电源的_________极
(2)A中发生反应的化学方程式为____________________________________。
(3)在B端观察到的现象是_____________________________________________。
(4)D端的电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,4g H2,11.2L O2,1mol H2O中,所含分子数最多的是______,含原子数最多的是________,质量最大的是________,体积最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用下图装置制取少量氮气。下列说法正确的是
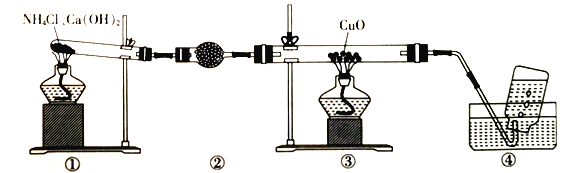
A. ②中盛放的是五氧化二磷
B. 实验开始时先点燃③的酒精灯,再点燃①的酒精灯
C. ③中玻璃管中的反应:2NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
D. 实验结束时先熄灭①、③的酒精灯,再将导管从水槽中拿出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 反应Fe+H2SO4![]() FeSO4+H2↑ 的能量变化如图所示:
FeSO4+H2↑ 的能量变化如图所示:

(1)该反应为__________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是__________;
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一电极材料,则铜为__________(填“正”或“负”)极。铜片上的现象为________________,该极上发生的电极反应为_______________;
II . 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线a,b,c如图所示。根据图中数据填空。

(1)该反应的化学方程式为______________;
(2)反应开始至2min,以气体Z表示的平均反应速率为_____________;
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_____________倍;
②达平衡时,容器内混合气体的平均相对分子质量和起始投料时相比__________(填“增大”“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com