
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:

(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式:____________。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。

【答案】+3价 ![]()
![]()
![]() 3Mg+B2O3
3Mg+B2O3![]() 2B+3MgO 防止MgCl2水解生成Mg(OH)2 0.045 mol·L-1 无 MgH2+2LiBH4=2LiH+MgB2+4H2↑ MgSO3的溶解度比CaSO3的大,MgSO3比CaSO3更易氧化
2B+3MgO 防止MgCl2水解生成Mg(OH)2 0.045 mol·L-1 无 MgH2+2LiBH4=2LiH+MgB2+4H2↑ MgSO3的溶解度比CaSO3的大,MgSO3比CaSO3更易氧化
【解析】
I.硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O.利用硼镁矿制取金属镁及粗硼的工艺流程中硼镁矿加入氢氧化钠浓溶液过滤得到氢氧化镁,加入浓盐酸溶解通过蒸发浓缩得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,经过电解得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,溶于热水后,用H2SO4调pH2~3制取H3BO3,加热得到B2O3;
(1)硼砂的化学式为Na2B4O710H2O,依据化合物中元素正负化合价代数和为0计算硼元素化合价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,X为H3BO3晶体加热脱水的产物判断为B2O3,高温下与Mg反应生成粗硼和氧化镁;
(2)氯化镁在水溶液中水解生成氢氧化镁;
(3)依据电解质溶液pH变化结合电池反应计算镁离子浓度;pH=6计算氢氧根离子浓度,结合生成镁离子浓度计算离子积Qc和溶度积常数比较分析是否生成氢氧化镁沉淀;
II.(4)由图分析可知,放氢过程的反应物是MgH2和LiBH4,生成物为LiH、H2和MgB2,根据氧化还原配平方法配平;
III.(5)根据Ksp(MgSO3)与Ksp(CaSO3)比较和MgSO3的性质分析解答。
I (1)根据硼砂的化学式Na2B4O710H2O和元素正负化合价的代数和为0,可得B的化合价为+3;B4O72-与H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O![]() 4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,高温下与Mg发生氧化还原反应,化学方程式为:3Mg+B2O3
4H3BO3;X为H3BO3晶体加热脱水的产物,为B2O3,高温下与Mg发生氧化还原反应,化学方程式为:3Mg+B2O3![]() 2B+3MgO;
2B+3MgO;
(2)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是:防止MgCl2水解生成Mg(OH)2;
(3)起始电解质溶液pH=1,pH=2时反应的H+为:0.1molL1-0.01molL1=0.09molL1,根据Mg+H2O2+2H+=Mg2++2H2O,可得Mg2+离子浓度为0.045 mol·L-1;溶液pH=6时,c(OH)=10-8molL1,Qc [Mg(OH)2]=0.045 mol·L-1×[10-8molL1]2=4.5×10-18 < Ksp[Mg(OH)2],所以没有Mg(OH)2沉淀析出;
II.(4)由图分析可知,放氢过程的反应物是MgH2和LiBH4,生成物为LiH、H2和MgB2,故放氢过程中发生反应的化学方程式为MgH2+2LiBH4=2LiH+MgB2+4H2↑;
III.(5)由题干信息可知,MgSO3溶解度比CaSO3大;MgSO3比CaSO3更易被氧化。


科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )

A. 曲线 M 表示 pH与lg![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组同学用下图所示的装置来制备溴苯并探究其反应类型。
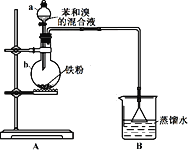
(1)仪器a名称为_________。B装置的作用是__________________。
(2)打开a的活塞将苯和溴的混合液滴入b中,反应立即开始。写出b中发生有机反应的化学方程式______________________。
(3)实验开始后,首先观察到b中液体沸腾,且装置内充满红棕色气体。然后观察到B中倒扣的漏斗内现象是__________________,说明b中反应有HBr生成,证明制备溴苯的反应是取代反应。
(4)甲同学向B装置的烧杯中滴入几滴AgNO3溶液,观察到_________________,据此进一步确证有HBr生成。乙同学认为甲同学的判断并不准确,则可能的理由是___________。如果要排除干扰,可在A、B之间增加一个洗气瓶,内装试剂可以是__________________(选填序号)。
①NaOH溶液 ②饱和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图所示,主要步骤如下(并非正确顺序):
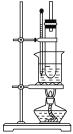
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中。
b.在50~60 ℃下发生反应,直至反应结束。
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
回答下列问题:
①步骤b中的加热方法为__________,其优点是_________________________________________。
②粗产品用5%NaOH溶液洗涤的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。

(1)阴影部分元素N在元素周期表中的位置为_____。根据元素周期律,预测酸性强弱:H3AsO4______H3PO4(填“>”或“<”)。
(2)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的程度比S与H2反应程度___(填“更大”“更小”或“相同”)。
(3)下列说法错误的是______(填序号)。
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③干冰升华、液态水转变为气态水都要克服分子内的共价键
④HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色的气体,E为Fe单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去.
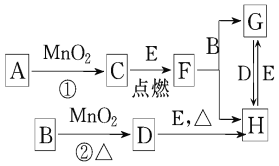
(1)写出有关物质的名称:B__________,F______________
(2)写出F与金属铝在高温下的反应化学方程式____________________________
(3)若反应①是在加热条件下进行的,则A是____________ (填化学式);
(4)指出MnO2在相关反应中的作用:反应②中是________剂.
(5)写出B与MnO2共热获得D的化学方程式: __________________________.
(6)实验室检验H中的阳离子的方法是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)

请回答下列问题:
(1)仪器1的名称是__________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是__________(填序号);目的是______________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门__________(填“A”或“B”,下同),打开阀门___________________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是__________________________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.024g,则该实验所得产品的产率为__________(不考虑溶解的M)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的________,再加入碱液,调节pH至少为________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31,![]() =4,lg2≈0.3)
=4,lg2≈0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,逐滴加入氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1的盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g;
下列说法中正确的是
A. 该溶液中可能含有Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 步骤②中产生的白色沉淀为硅酸
D. 该溶液是否有K+需做焰色反应实验 (透过蓝色钴玻璃片)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
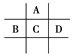
(1)A与E形成化合物的化学式是_____。
(2)B的最高价氧化物化学式为_______,C的元素名称为______,D的单质与水反应的方程式为_______。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现是____,有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:3H2+N2 ![]() 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
A. 3v(H2)正=v(N2)逆 B. v(H2)生成=v(NH3)生成
C. 2v(N2)消耗=v(NH3)消耗 D. 3v(H2)逆=2v(NH3)正
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com