
【题目】兴趣小组同学用下图所示的装置来制备溴苯并探究其反应类型。
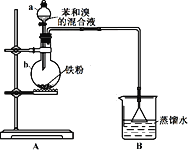
(1)仪器a名称为_________。B装置的作用是__________________。
(2)打开a的活塞将苯和溴的混合液滴入b中,反应立即开始。写出b中发生有机反应的化学方程式______________________。
(3)实验开始后,首先观察到b中液体沸腾,且装置内充满红棕色气体。然后观察到B中倒扣的漏斗内现象是__________________,说明b中反应有HBr生成,证明制备溴苯的反应是取代反应。
(4)甲同学向B装置的烧杯中滴入几滴AgNO3溶液,观察到_________________,据此进一步确证有HBr生成。乙同学认为甲同学的判断并不准确,则可能的理由是___________。如果要排除干扰,可在A、B之间增加一个洗气瓶,内装试剂可以是__________________(选填序号)。
①NaOH溶液 ②饱和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图所示,主要步骤如下(并非正确顺序):
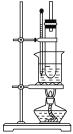
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中。
b.在50~60 ℃下发生反应,直至反应结束。
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
回答下列问题:
①步骤b中的加热方法为__________,其优点是_________________________________________。
②粗产品用5%NaOH溶液洗涤的目的是_____________。
【答案】分液漏斗 吸收HBr,防止液体倒吸 ![]() +Br2
+Br2![]()
![]() +HBr 出现白雾,液面上升 烧杯中产生浅黄色沉淀 Br2蒸气进入AgNO3溶液也会产生浅黄色沉淀 ④ 水浴加热 受热均匀,易控制温度 除去粗产品中残留的酸
+HBr 出现白雾,液面上升 烧杯中产生浅黄色沉淀 Br2蒸气进入AgNO3溶液也会产生浅黄色沉淀 ④ 水浴加热 受热均匀,易控制温度 除去粗产品中残留的酸
【解析】
(1) B装置的作用是吸收HBr,防止液体倒吸;
(2)苯和溴在溴化铁作催化剂条件下生成溴苯和溴化氢;
(3)反应产生的HBr极易溶于水,气压减小,且会与水蒸气结合成小液滴,有白雾;
(4) AgNO3溶液与HBr和Br2蒸气均会产生溴化银沉淀。如果要排除干扰,可在A、B之间增加一个洗气瓶,除去HBr中的Br2蒸气;
(5) ①50~60 ℃采用水浴加热,优点是受热均匀,易控制温度;
②5%NaOH溶液洗涤的目的是除去粗产品中残留的酸。
(1)仪器a名称为分液漏斗。反应产生的HBr经长导管进入B装置,B装置倒置的漏斗具有较大的空间可防止倒吸,故B装置的作用是吸收HBr,防止液体倒吸;
(2)苯和溴在溴化铁作催化剂条件下生成溴苯和溴化氢,发生的有机反应的化学方程式为![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(3) 反应产生的HBr极易溶于水,会与水蒸气结合成小液滴,故倒扣的漏斗内现象是出现白雾,液面上升。
(4) B装置的烧杯中有AgNO3溶液,会产生溴化银沉淀,故观察到烧杯中产生浅黄色沉淀。溴易挥发,Br2蒸气进入AgNO3溶液也会产生浅黄色沉淀,不能确证有HBr生成。如果要排除干扰,可在A、B之间增加一个洗气瓶,除去HBr中的Br2蒸气,
①NaOH溶液会与HBr反应,故①错误;
②饱和Na2CO3溶液会与HBr反应,故②错误;
③Na2SO3溶液会与HBr反应,故③错误;
④CCl4不会与HBr反应,且能吸收Br2蒸气,故④正确;
答案选④;
(5) ①在50~60 ℃下发生反应,故步骤b中的加热方法为水浴加热,其优点是受热均匀,易控制温度;
②除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,先用蒸馏水除去部分酸,粗产品用5%NaOH溶液洗涤的目的是除去粗产品中残留的酸。


科目:高中化学 来源: 题型:
【题目】下列过程中,破坏的作用力相同的是
A.干冰升华和碘升华B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化D.NH4Cl受热分解和HI受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是

A. b~c溶液中所有离子浓度都减小
B. b点溶液pH=7,说明NH4R没有水解
C. c点溶液中存在c(R-) > c(NH4+)、c(H+)> c(OH-)
D. a~b导电能力增强,说明HR为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为________________。
(2) NH3和H2O中稳定性较高的是:___________,NH3和PH3中沸点较高的是:__________。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

①装置中气体A为________(填“CH4”或“O2和CO2”),d极上的电极反应式为_______________________________________。
②乙装置中a极上的电极反应式为___________________。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4________mL(标准状况),乙装置中所得溶液的pH=________(忽略电解前后溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法不正确的是
A. 金刚石、红磷都属于单质 B. 漂白粉、玻璃都属于混合物
C. 氯化铵、氨气都属于电解质 D. 生铁、青铜都属于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )

A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:

(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式:____________。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____mol·L-1·s-1。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A 压强不再变化 B υ(A)正=2υ(B)逆
C 气体密度不再变化 D A的百分含量保持不变
E A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”)其电极反应式为______。
(2)电子由_____极经外电路流向___极(填“Ag2O”或“Al”),当有 1mol电子流经外电路时,负极质量减少___g。
(3)溶液中的 OH-向____极迁移(填“Ag2O”或“Al”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com