
【题目】Ⅰ.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____mol·L-1·s-1。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A 压强不再变化 B υ(A)正=2υ(B)逆
C 气体密度不再变化 D A的百分含量保持不变
E A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”)其电极反应式为______。
(2)电子由_____极经外电路流向___极(填“Ag2O”或“Al”),当有 1mol电子流经外电路时,负极质量减少___g。
(3)溶液中的 OH-向____极迁移(填“Ag2O”或“Al”)。
【答案】0.01 3 BCD 正 Ag2O+2e-+H2O=2Ag+2OH- Al Ag2O 9 Al
【解析】
(1)2min达到平衡,C的浓度为1.2mol/L,结合![]() 计算;
计算;
(2)2min时反应达到平衡状态,此时剩余1.2mol B,计算B的反应速率,反应速率之比等于化学计量数之比;
(3)反应达到平衡状态正逆反应速率相等,各组分含量保持不变,据此分析作答;
Ⅱ. 该原电池中,Al元素化合价由0价变为+3价而发生氧化反应,所以为负极,则Ag2O为正极;失电子的物质发生氧化反应,被氧化;放电时,电子从负极沿导线流向正极;电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析作答。
(1)2min达到平衡,C的浓度为1.2mol/L,由![]() =
=![]() =0.6mol/(L·min),υ(C)=
=0.6mol/(L·min),υ(C)=![]() mol/(L·s)=0.01mol/(L·s);
mol/(L·s)=0.01mol/(L·s);
(2)2min时反应达到平衡状态,此时剩余1.2mol B,则B的反应速率为![]() =0.2mol/(L·min),由反应速率之比等于化学计量数之比可知,x=3,故答案为:3;
=0.2mol/(L·min),由反应速率之比等于化学计量数之比可知,x=3,故答案为:3;
(3)2A(g)+B(g)3C(g)+2D(s),反应前后气体体积不变,则
A. 反应前后气体体积不变,反应过程中和平衡状态下压强始终不变化,压强不变不能说明反应达到平衡状态,A项错误;
B. 反应速率之比等于化学方程式系数之比,υ(A)正=2υ(B)逆,说明正逆反应速率相等,反应达到平衡状态,B项正确;
C. 反应前后气体质量变化,气体体积不变,气体密度不再变化,说明反应达到平衡状态,C项正确;
D. A的百分含量保持不变,则说明反应达到平衡状态,D项正确;
E. A的消耗速率与C的消耗速率之比为2:1,根据化学计量数易知,不能说明正逆反应速率相等,即不能表明反应达到平衡状态,E项错误;
故答案为:BCD;
Ⅱ. 该原电池中,Al元素化合价由0价变为+3价而发生氧化反应,所以为负极,则Ag2O为正极;,
(1)根据原电池工作原理,化合价升高,失电子的作负极,即铝单质作负极,则Ag2O作电池的正极,其电极反应式为:Ag2O+2e-+H2O=2Ag+2OH-;
(2)电子由Al极经外电路流向Ag2O极;负极电极反应式为:Al-3e- +4OH-=AlO2-+2H2O,当有1mol电子流经外电路时,负极质量减少![]() =9g;
=9g;
(3)放电过程中,溶液中的阴离子向负极移动,则溶液中的OH-向Al极移动,故答案为:Al。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】兴趣小组同学用下图所示的装置来制备溴苯并探究其反应类型。
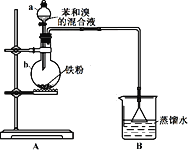
(1)仪器a名称为_________。B装置的作用是__________________。
(2)打开a的活塞将苯和溴的混合液滴入b中,反应立即开始。写出b中发生有机反应的化学方程式______________________。
(3)实验开始后,首先观察到b中液体沸腾,且装置内充满红棕色气体。然后观察到B中倒扣的漏斗内现象是__________________,说明b中反应有HBr生成,证明制备溴苯的反应是取代反应。
(4)甲同学向B装置的烧杯中滴入几滴AgNO3溶液,观察到_________________,据此进一步确证有HBr生成。乙同学认为甲同学的判断并不准确,则可能的理由是___________。如果要排除干扰,可在A、B之间增加一个洗气瓶,内装试剂可以是__________________(选填序号)。
①NaOH溶液 ②饱和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图所示,主要步骤如下(并非正确顺序):
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中。
b.在50~60 ℃下发生反应,直至反应结束。
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
回答下列问题:
①步骤b中的加热方法为__________,其优点是_________________________________________。
②粗产品用5%NaOH溶液洗涤的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,逐滴加入氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1的盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g;
下列说法中正确的是
A. 该溶液中可能含有Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 步骤②中产生的白色沉淀为硅酸
D. 该溶液是否有K+需做焰色反应实验 (透过蓝色钴玻璃片)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
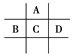
(1)A与E形成化合物的化学式是_____。
(2)B的最高价氧化物化学式为_______,C的元素名称为______,D的单质与水反应的方程式为_______。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现是____,有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(B)=0.3 mol·L-1· s-1B. v(A)=0.5mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=30 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某烷烃与烯烃的混合气体9.00g,该混合气体的密度为相同状况下氢气的11.25倍,将混合气体通过足量溴水,溴水质量增加4.20g,则原混合气体的组成为( )
A. 甲烷 、乙烯B. 乙烷 、乙烯C. 甲烷 、丙烯D. 甲烷 、丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料。具体合成路线如图所示 ( 部分反应条件略去 ):
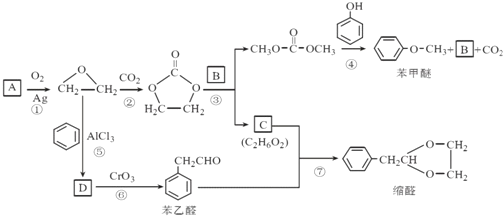
已知:①![]()
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%.
回答下列问题:
(1)A的名称是 ___ ,图中缩醛的分子式是 ___.
(2)B的结构简式为 ___.
(3)⑤的化学方程式为 ___.
(4)⑥的反应类型是 ___.
(5)请写出核磁共振氢谱有 4 组峰 , 峰面积之比为 3:2:2:1, 并含有苯环和![]() 结构的苯乙醛的所有同分异构体的结构简式: ___.
结构的苯乙醛的所有同分异构体的结构简式: ___.
(6)参照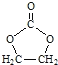 的合成路线,设计一条由2氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2氯丙烷和必要的无机试剂制备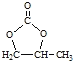 的合成路线(注明必要的反应条件 )___。
的合成路线(注明必要的反应条件 )___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:3H2+N2 ![]() 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
A. 3v(H2)正=v(N2)逆 B. v(H2)生成=v(NH3)生成
C. 2v(N2)消耗=v(NH3)消耗 D. 3v(H2)逆=2v(NH3)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com