
【题目】有某烷烃与烯烃的混合气体9.00g,该混合气体的密度为相同状况下氢气的11.25倍,将混合气体通过足量溴水,溴水质量增加4.20g,则原混合气体的组成为( )
A. 甲烷 、乙烯B. 乙烷 、乙烯C. 甲烷 、丙烯D. 甲烷 、丁烯
【答案】C
【解析】
根据混合气体密度为相同状况下氢气密度的11.2倍,计算混合气体的平均摩尔质量;可确定烷烃,计算混合气体的物质的量。混合气体通过足量的溴水,溴水增重4.2g为烯烃质量,进而计算烷烃的质量、烷烃的物质的量,结合混合气体总的物质的量计算烯烃的物质的量,进而计算烯烃的摩尔质量,利用烯烃组成通式,确定烯烃。
由气态烷烃和气态单烯烃组成的混合气体的密度是同种状况下H2密度的11.2倍,则根据ρ=![]() 可知M(混合)=11.2×2g/mol=22.4g/mol,烯烃的摩尔质量最小的是乙烯,摩尔质量为28g/mol,则烷烃的摩尔质量应小于22.4g/mol,所以混合气体中一定含有甲烷。
可知M(混合)=11.2×2g/mol=22.4g/mol,烯烃的摩尔质量最小的是乙烯,摩尔质量为28g/mol,则烷烃的摩尔质量应小于22.4g/mol,所以混合气体中一定含有甲烷。
混合气体的物质的量n(混合)=![]() =0.4mol,混合气体通过足量的溴水,溴水增重4.2g为烯烃的质量,则混合气体中甲烷的质量为m(甲烷)=9g-4.2g=4.8g,那么甲烷的物质的量为n(CH4)=
=0.4mol,混合气体通过足量的溴水,溴水增重4.2g为烯烃的质量,则混合气体中甲烷的质量为m(甲烷)=9g-4.2g=4.8g,那么甲烷的物质的量为n(CH4)=![]() =0.3mol,所以烯烃的物质的量为0.4mol-0.3mol=0.1mol,因此烯烃的摩尔质量M=
=0.3mol,所以烯烃的物质的量为0.4mol-0.3mol=0.1mol,因此烯烃的摩尔质量M=![]() =42g/mol,设烯烃的化学式为CnH2n,则12n+2n=42,解得n=3,因此该烯烃为丙烯,则该混合物为甲烷与丙烯的气体。故合理选项是C。
=42g/mol,设烯烃的化学式为CnH2n,则12n+2n=42,解得n=3,因此该烯烃为丙烯,则该混合物为甲烷与丙烯的气体。故合理选项是C。


科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法不正确的是
A. 金刚石、红磷都属于单质 B. 漂白粉、玻璃都属于混合物
C. 氯化铵、氨气都属于电解质 D. 生铁、青铜都属于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家规定,从2001年2月1日起全国停止生产含 铅汽油,改用无铅汽油。无铅汽油的含义是
A.汽油中绝对不含铅元素B.汽油中不含人为添加的含铅元素的物质
C.汽油中含铅元素在一定指标范围之内D.以上都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种常用的氧化剂。如图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):

相关物质不同温度下的溶解度(单位:g)数据如表:
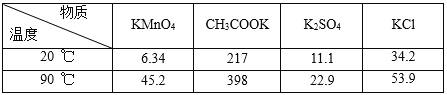
(1)“熔融”步骤反应的化学方程式为_____。
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:_____。
(3)操作2是_____、_____、_____。
(4)图中可以直接进行循环利用的物质是_____(填化学式)。
(5)KMnO4粗晶体中的主要杂质(填化学式)有_____和_____,若用硫酸代替图中的冰醋酸,则导致的问题及原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____mol·L-1·s-1。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A 压强不再变化 B υ(A)正=2υ(B)逆
C 气体密度不再变化 D A的百分含量保持不变
E A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”)其电极反应式为______。
(2)电子由_____极经外电路流向___极(填“Ag2O”或“Al”),当有 1mol电子流经外电路时,负极质量减少___g。
(3)溶液中的 OH-向____极迁移(填“Ag2O”或“Al”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种元素的原子序数之和等于36.A的单质是最轻的气体;B的基态原子有3个不同的能级,各能级中电子数相等;D有“生物金属”之称,其单质和化合物有广泛的用途,D4+离子和氩原子的核外电子排布相同.工业上利用DO2和碳酸钡在熔融状态下制取化合物甲(甲可看做一种含氧酸盐).化合物甲有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,化合物甲晶体的晶胞结构为立方体(如下图所示),其中Ba2+占据体心位置,O2-占据棱心位置,D4+占据顶点位置.
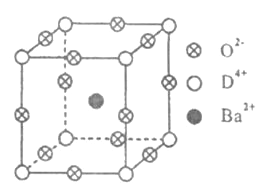
请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是__________________(填元素符号).
(2)BA4分子的空间构型是______________;B原子轨道的杂化类型为_____.
(3)C的气态氢化物的电子式为____;其沸点高于同主族其他元素氢化物的沸点,主要原因是____________________.
(4)D的基态原子核外电子排布式为____________________.
(5)①制备化合物甲的化学方程式为____________________.
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的__________.
③在甲晶体中,D4+的氧配位数为__________.
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为__________________g/cm3(要求列出算式,阿伏加德罗常数用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,4g H2,11.2L O2,1mol H2O中,所含分子数最多的是______,含原子数最多的是________,质量最大的是________,体积最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。
Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4=Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:

实验(二)Li2FeSiO4含量测定:

从仪器B中取20.00mL溶液至锥形瓶中,另取0.20molL-1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 22.40mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B____,仪器C____。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是____。
(3)在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需____;
(4)操作Ⅱ的步骤是:__、__、过滤、洗涤。
(5)还原剂A可用SO2,写出该反应的离子方程式____,此时后续处理的主要目的是____。
(6)滴定终点时现象为____;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为____;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com