
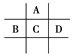
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
(1)A与E形成化合物的化学式是_____。
(2)B的最高价氧化物化学式为_______,C的元素名称为______,D的单质与水反应的方程式为_______。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现是____,有关反应的离子方程式为________。
【答案】Al2O3 P2O5 硫 Cl2+H2O![]() HCl+HClO 先有白色胶状沉淀产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清 Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O
HCl+HClO 先有白色胶状沉淀产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清 Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O
【解析】
根据原子结构及元素周期表的结构推测元素的种类,根据元素性质分析解答。
设A的原子序数为x,则同主族的元素C原子序数为x+8,与C同周期的元素B原子序数为x+7,D的原子序数为x+9,则x+(x+8)+(x+7)+(x+9)=56,则x=8,则A为氧,B为磷,C为硫,D为氯;1molE置换出H2的物质的量为33.6L/22.4L/mol=1.5mol/L,根据电子转移守恒推测1molE失去3mol电子,E的阳离子与A的阴离子核外电子层结构完全相同,则E为铝;
(1)A为O,E为Al,形成化合物的化学式是Al2O3;
(2)B为P,最外层电子数为5,则其最高价氧化物化学式为P2O5;C为S,元素名称为硫;D为氯,氯气与水反应的方程式为 Cl2+H2O![]() HCl+HClO;
HCl+HClO;
(3)D与E形成的化合物为AlCl3,氯化铝溶液与氢氧化钠溶液反应先生成氢氧化铝沉淀,氢氧化铝为两性,又与氢氧化钠溶液反应生成偏铝酸钠,所以观察到的现是先有白色胶状沉淀产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清;有关反应的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:

(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式:____________。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家规定,从2001年2月1日起全国停止生产含 铅汽油,改用无铅汽油。无铅汽油的含义是
A.汽油中绝对不含铅元素B.汽油中不含人为添加的含铅元素的物质
C.汽油中含铅元素在一定指标范围之内D.以上都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
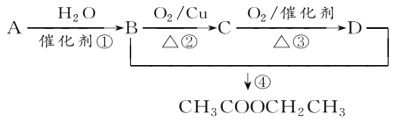
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是__________________、________________。
(3)写出下列反应的反应类型:①________,②________,④________。
(4)写出下列反应的化学方程式:
①_______________________________;
④_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种常用的氧化剂。如图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):

相关物质不同温度下的溶解度(单位:g)数据如表:
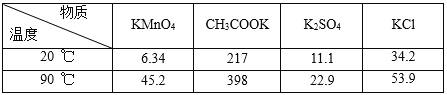
(1)“熔融”步骤反应的化学方程式为_____。
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:_____。
(3)操作2是_____、_____、_____。
(4)图中可以直接进行循环利用的物质是_____(填化学式)。
(5)KMnO4粗晶体中的主要杂质(填化学式)有_____和_____,若用硫酸代替图中的冰醋酸,则导致的问题及原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol·L-1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____mol·L-1·s-1。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A 压强不再变化 B υ(A)正=2υ(B)逆
C 气体密度不再变化 D A的百分含量保持不变
E A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”)其电极反应式为______。
(2)电子由_____极经外电路流向___极(填“Ag2O”或“Al”),当有 1mol电子流经外电路时,负极质量减少___g。
(3)溶液中的 OH-向____极迁移(填“Ag2O”或“Al”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
2SO3(g) (正反应为放热反应),SO2的物质的量随时间变化的关系如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法错误的是
A. 4~5min内,该反应的正、逆反应速率相等
B. 若要提高SO3的产率,则可用过量的空气代替O2
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.015mol/ (L·min)
D. 容器内反应达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com