
【题目】常温下,向10 mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是

A. b~c溶液中所有离子浓度都减小
B. b点溶液pH=7,说明NH4R没有水解
C. c点溶液中存在c(R-) > c(NH4+)、c(H+)> c(OH-)
D. a~b导电能力增强,说明HR为弱酸
【答案】D
【解析】
A.根据溶液中的溶质进行分析;
B.弱酸的阴离子或弱碱的阳离子在水溶液中会发生水解反应;
C.c点溶液的pH>7,说明溶液呈碱性,溶液中c(OH-)>c(H+),再结合电荷守恒判断;
D.溶液导电能力与离子浓度成正比,如果HR是强电解质,加入氨水至溶液呈中性时,溶液中离子浓度会减小,导致溶液导电能力降低。
A. b~c段溶液的溶质为NH3·H2O、NH4R,溶液由中性变为弱碱性,OH-的浓度增大,故A错误;
B.弱酸的阴离子或弱碱的阳离子在水溶液中会发生水解反应,HR是弱酸,且一水合氨是弱碱,所以NH4R是弱酸弱碱盐,b点溶液呈中性,此时酸和碱恰好完全反应,所以该点溶液中铵根离子和酸根离子水解程度相同,故B错误;
C.c点溶质为NH3·H2O、NH4R,此时溶液呈碱性,说明NH3·H2O的电离程度大,因此溶液中c(OH-)>c(H+),再结合电荷守恒得c(NH4+)>c(R-),故C错误;
D.加入10mL等浓度的氨水,两者恰好完全反应,HR+NH3·H2O=NH4R+H2O,假设HR为强酸,NH4R是强电解质,反应前后导电能力基本相同,但a~b导电能力增强,因此假设错误,HR为弱酸,故D正确。
故选D。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】(1)氯原子核外有________种不同运动状态的电子;基态溴原子的价电子排布式为_______;比较氟、氯、溴单质熔点的高低并说明理由___________。
(2)HF极易溶于水的原因是______。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(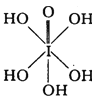 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(多选,填字母);
A.金属键B.离子键 C.极性键D.非极性键E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂能用于鉴别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③④⑤B.③④
C.①②③⑤D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )

A. 曲线 M 表示 pH与lg![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是
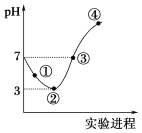
A. 曲线③④段有离子反应:HClO+OH-===ClO-+H2O
B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯气与氢氧化钠溶液恰好反应完全
D. ①处c(H+)约为②处c(H+)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH—O共价键放出463kJ的热量。反应2H2(g)+O2(g)=2H2O(g)的能量变化如右图所示。下列说法正确的是

A. 2H(g)→H2(g) ![]() H >0
H >0
B. 图中E1 = 932kJ
C. 图中E2 = 926 kJ
D. 2H2(g)+O2(g)=2H2O(g) ![]() H =-484 kJ·mol-1
H =-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法不正确的是( )
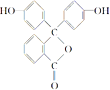
A. 酚酞属于芳香族化合物
B. 酚酞的分子式为C20H14O4
C. 分子中所有碳原子可能共平面
D. 酚酞具有官能团羟基能与钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组同学用下图所示的装置来制备溴苯并探究其反应类型。
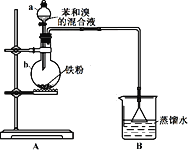
(1)仪器a名称为_________。B装置的作用是__________________。
(2)打开a的活塞将苯和溴的混合液滴入b中,反应立即开始。写出b中发生有机反应的化学方程式______________________。
(3)实验开始后,首先观察到b中液体沸腾,且装置内充满红棕色气体。然后观察到B中倒扣的漏斗内现象是__________________,说明b中反应有HBr生成,证明制备溴苯的反应是取代反应。
(4)甲同学向B装置的烧杯中滴入几滴AgNO3溶液,观察到_________________,据此进一步确证有HBr生成。乙同学认为甲同学的判断并不准确,则可能的理由是___________。如果要排除干扰,可在A、B之间增加一个洗气瓶,内装试剂可以是__________________(选填序号)。
①NaOH溶液 ②饱和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图所示,主要步骤如下(并非正确顺序):
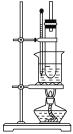
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中。
b.在50~60 ℃下发生反应,直至反应结束。
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
回答下列问题:
①步骤b中的加热方法为__________,其优点是_________________________________________。
②粗产品用5%NaOH溶液洗涤的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,逐滴加入氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1的盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g;
下列说法中正确的是
A. 该溶液中可能含有Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 步骤②中产生的白色沉淀为硅酸
D. 该溶液是否有K+需做焰色反应实验 (透过蓝色钴玻璃片)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com