
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
【答案】10g ![]()
![]() 、
、![]()
![]()
![]()
![]()
![]()
【解析】
通过①得出铵根离子物质的量,
通过②分析得出碳酸根和硫酸根的物质的量,
通过③及离子共存分体得出不含的离子,
通过④分析含有的微粒及物质的量。
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L,应生成NH3,则一定含有NH4+,且![]() ;
;
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液,沉淀可能为BaSO4或BaCO3或二者都有,
如为BaSO4,则![]() ,
,
如为BaCO3,![]() ,
,
则说明甲中含有SO42-、CO32-,设分别为x mol、y mol,
则![]() ,x = 0.2 ,y = 0.1;
,x = 0.2 ,y = 0.1;
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X,则说明含有CO32-,则一定不存在Ca2+、Cu2+;
④向上述滤液中加入1 mol/LAgNO3溶液650mL,恰好可完全反应,可知滤液中![]() ,而②加入
,而②加入![]() ,
,
则说明甲中含有Cl-,且![]() ,
,
如不含NO3-,则由电荷守恒可知一定含有K+,由![]() ,
,
则![]() ,
,
因分成两份,则甲含有0.4 mol NH4+、0.9 mol K+、0.4 mol SO42-、0.2 mol CO32-、0.1mol Cl-,如含有NO3-,则K+大于0.9 mol,
⑴上述实验③中得到沉淀X为碳酸钙,质量为0.1 mol × 100 g/mol=10g,生成沉淀X的离子方程式为Ca2+ + 2OH- + CO2== CaCO3↓ + H2O,
故答案为:10g;Ca2+ + 2OH- + CO2== CaCO3↓ + H2O;
⑵由以上分析可知一定不存在Ca2+、Cu2+,不能确定是否含有NO3-,
故答案为:Ca2+、Cu2+;NO3-;
⑶甲含有0.4 mol N4+、0.9 mol K+、0.4 mol SO42-、0.2 mol CO32-、0.1mol Cl-,如含有NO3-,则K+大于0.9 mol,则物质的量最大的离子是K+;物质的量最小的离子是Cl-,此物质的量最小的离子其物质的量为0.1 mol,
故答案为:K+;Cl-;0.1 mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有下列6种物质
①![]() ②
②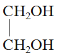 ③
③![]()
④CH3-CH=CH-CH3 ⑤![]() ⑥
⑥![]()
(1)用于制造炸药TNT的是____(填序号)。
(2)具有两性的是______(填序号)。
(3)有机物①的沸点比②______(填“高”或“低”)
(4)有机物④的名称是___________
(5)有机物④形成的高聚物结构简式为__________________
(6)检验有机物⑥中官能团的试剂是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法正确的是
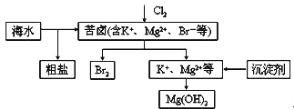
A. 得到的 Mg(0H)2 是耐火砖的主要成分
B. 粗盐可采用除杂和蒸馏等过程提纯
C. 工业生产中常选用 NaOH 作为沉淀剂
D. 富集溴一般先用空气或水蒸气吹出单质溴,再用碱液或SO2 等吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:

(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素存在于黑香豆、香蛇鞭菊、野香荚兰、兰花中,具有新鲜干草香和香豆香,是一种口服抗凝药物。实验室合成香豆素的反应和实验装置如下:

可能用到的有关性质如下:
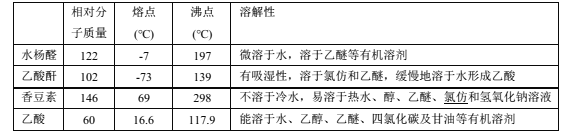
合成反应:
向三颈烧瓶中加入95%的水杨醛38.5g、新蒸过的乙酸酐73g和1g无水乙酸 钾,然后加热升温,三颈烧瓶内温度控制在145~150℃,控制好蒸汽温度。此时,乙酸开始蒸出。当蒸出量约15g时,开始滴加15g乙酸酐,其滴加速度应与乙酸蒸出的速度相当。乙酸酐滴加完毕后,隔一定时间,发现气温不易控制在120℃时,可继续提高内温至208℃左右,并维持15min至半小时,然后自然冷却。
分离提纯:
当温度冷却至80℃左右时,在搅拌下用热水洗涤,静置分出水层,油层用10%的 碳酸钠溶液进行中和,呈微碱性,再用热水洗涤至中性,除去水层,将油层进行减压蒸馏,收集150~160℃/1866Pa馏分为粗产物。将粗产物用95%乙醇(乙醇与粗产物的质量比为1:1)进行重结晶,得到香豆素纯品35.0g。
(1)装置a的名称是_________。
(2)乙酸酐过量的目的是___________。
(3)分水器的作用是________。
(4)使用油浴加热的优点是________。
(5)合成反应中,蒸汽温度的最佳范围是_____(填正确答案标号)。
a.100~110℃ b.117.9~127.9℃ c.139~149℃
(6)判断反应基本完全的现象是___________。
(7)油层用10%的碳酸钠溶液进行中和时主要反应的离子方程式为______。
(8)减压蒸馏时,应该选用下图中的冷凝管是_____(填正确答案标号)。
a.直形冷凝管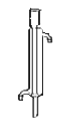 b.球形冷凝管
b.球形冷凝管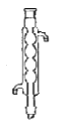 c.蛇形冷凝管
c.蛇形冷凝管
(9)本实验所得到的香豆素产率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成中间体L的路线如下(部分反应条件或试剂略去):

已知: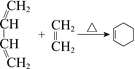
![]()

(1)A的名称是______。
(2)A与Br2按物质的量之比1︰1发生1,4-加成反应生成B,A→B的化学方程式是______。
(3)B→C的反应类型是______。
(4)D中所含官能团的名称是______。
(5)E与NaOH的乙醇溶液反应的化学方程式是______。
(6)C→D在上述合成中的作用是______。
(7)J的结构简式是______。
(8)K→L的化学方程式是______。
(9)设计由L制备M(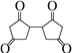 )的合成路线______(有机物用结构简式表示,无机试剂任选)。
)的合成路线______(有机物用结构简式表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素剧期表的一部分,请根据要求填空

(1) 元素②最外层有_____个电子,在化合物中的最低负化合价为________;
(2) 元素⑤形成的离子的结构汞意图为_________;
(3) 用电子式表示元素①和⑦组成的化合物的形成过程:_______________;
(4) 元素④、⑤的最高价氧化物的水化物之间发生反应的离子方程式______________ 。
(5) 下列选项中能证明元素⑦的非金属性强于元素⑥的是________(双选)。
A.H2S的酸性弱于HCl B.S2-的还原性强于C1-
C.H2SO3的酸性强于HClO D.H2S不如HC1稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1 NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)-c(CO32-)
B. 0.1 mol·L-1 NaHC2O4溶液呈酸性:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C. 20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. 向0.1mol·L-1 NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
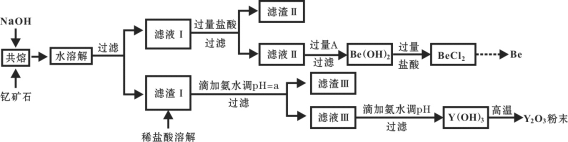
已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)将钇矿石与NaOH共熔的反应方程式补充完整:
__Y2FeBe2Si2O10+__NaOH+____ ![]() __Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
__Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
(2)滤渣Ⅱ的主要成分是____________。
(3)试剂A可以是___________。
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是_____________________。
(5)计算常温下Y3+ +3H2O![]() Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为_______________。
(7)从BeCl2溶液中得到BeCl2固体的操作是________。
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com