
【题目】25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1 NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)-c(CO32-)
B. 0.1 mol·L-1 NaHC2O4溶液呈酸性:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C. 20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. 向0.1mol·L-1 NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
【答案】C
【解析】
A、碳酸氢钠溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),选项A错误;
B.0.1 molL-1NaHC2O4溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),正确的浓度大小为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),选项B错误;
C、20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,由电荷守恒可知:n(CH3COO-)+n(OH-)=n(Na+)+n(H+);根据物料守恒知n(CH3COO-)+n(CH3COOH)=2×10-3 mol,n(Na+)=10-3mol,n(CH3COO-)+n(OH-)=![]() [n(CH3COO-)+n(CH3COOH)]+n(H+),所以c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项C正确;
[n(CH3COO-)+n(CH3COOH)]+n(H+),所以c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项C正确;
D.0.1 mol/LNH4HSO4溶液中滴加NaOH至溶液恰好呈中性,则NH4+水解会减少,SO42-无变化,所以离子浓度关系是:c(Na+) >c(SO42-)>c(NH4+)>c(OH-) =c(H+),选项D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】如图所示表示页岩气中某些烃类的结构模型:

(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种![]() 为确定甲溶液的组成,将其分成两等份,进行如下实验:
为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生的气体在标准状况下体积为4.48L。
②向另一份溶液中加入0.6 mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得66.3g沉淀及滤液。
③向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清的石灰水中,得到一定量的沉淀X。
④向上述滤液中加入1 mol/L AgNO3溶液650 mL,恰好可完全反应,据此,请回答下列问题![]() 用相应的离子符号表示
用相应的离子符号表示![]() :
:
⑴上述实验③中得到沉淀X的质量为______;生成沉淀X的离子方程式为______.
⑵甲溶液中一定不存在的离子是______;可能存在的离子是______.
⑶甲溶液一定存在的离子中,物质的量最大的离子是______;物质的量最小的离子是______,此物质的量最小的离子其物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在![]() 、
、![]() N、
N、![]() O、
O、![]() Cl、
Cl、![]() U、
U、![]() U中:
U中:
(1)___和_____的质量数相等,但不能互称为同位素。
(2)___和____的中子数相等,但质子数不相等,所以不是同一种元素。以上所列共有______种元素。
Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(3)Y的分子式为________。
(4)图中X的电子式为![]() ;其水溶液长期在空气中放置容易变浑浊,原因是________(用化学方程式表示);该变化体现出:S非金属性比O____(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,__________,得电子能力逐渐减弱。
;其水溶液长期在空气中放置容易变浑浊,原因是________(用化学方程式表示);该变化体现出:S非金属性比O____(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,__________,得电子能力逐渐减弱。
(5)Z与图表中某物质反应生成SO2的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X的化学式是_____、Y的化学式是_____、Z的名称是_____。
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是_____。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的一种阳离子是_____。
(4)由X、Y、Z元素按原子个数比为4:2:3组成的化合物,该化合物的化学式(分子式)是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种漂白剂、脱氧剂和防腐剂。某研究小组对Na2S2O4的性质与制备进行了如下探究。
(1)测定0.05mol·L-1 Na2S2O4溶液在空气中pH的变化如图所示。
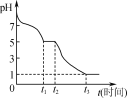
①写出0~t1段发生反应的化学方程式:_____。
②t2~t3段溶液的pH变小的原因是______。
(2)已知:S2O32-+2H+===SO2↑+S↓+H2O。Na2S2O4固体在隔绝空气的条件下加热至75℃以上完全分解得到Na2SO3、Na2S2O3和SO2,检验产物中是否含有Na2SO4,实验方法是__________。
(3)由工业废气制备Na2S2O4的实验原理如下:
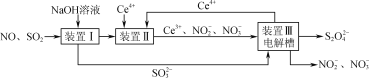
①向装置Ⅱ中加入Ce4+的目的是________。
②写出装置Ⅲ中发生反应的离子方程式:________。
(4)由锌粉法制备Na2S2O4的实验装置如图所示。主要步骤如下:

步骤1:将SO2通入锌粉的水悬浮液中,于35~45℃下反应生成连二亚硫酸锌。
步骤2:加入过量烧碱溶液,于28~35 ℃下反应生成Na2S2O4和氢氧化锌悬浮溶液。
由上述实验进一步提纯得到Na2S2O4(s)的实验方案是取一定量的Na2S2O4和氢氧化锌悬浮溶液,______(实验中须使用的试剂有:氯化钠、乙醇;除常规仪器外须使用的仪器有:真空干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2甲烷化是一种实现CO2资源化利用的有效途径。
Ⅰ.热化学转化
CO2甲烷化过程发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)ΔH
CH4(g)+2H2O(g)ΔH
(1)每生成1mol CH4(g),放热165 kJ,则ΔH=______。
(2)反应的平衡常数的表达式:K=______。温度升高,K______(填“增大”或“减小”)。
(3)其他条件不变时,一段时间内,压强对CO2的转化率及CH4的选择性的影响如下图。

注:选择性=转化为目标产物的原料量÷原料总的转化量
CO2甲烷化反应选择0.1MPa而不选择更高压强的原因是______。
Ⅱ.电化学转化
多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如下。电解过程中温度控制在10℃左右,持续通入CO2。阴、阳极室的KHCO3溶液的浓度基本保持不变。

(4)多晶Cu作______(填“阴”或“阳”)极。
(5)结合电极反应式,说明阴极室KHCO3溶液浓度基本不变的原因:______。
(6)上述电解过程中采取了______措施(写2条即可)使CO2优先于H+放电。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷在氧气中燃烧的反应为:P4 + 5O2 = P4O10。已知下列化学键的键能分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据,下列推断正确的是

A.6a+5d < 4c + 10b
B.△H = (4c+12b-6a-5d) kJ·mol-1
C.6a+5d > 4c + 12b
D.△H = (6a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com