
【题目】建设美丽中国,倡导共同行动,努力改善环境,保护家园,下列说法正确的是
A. 把硝酸工厂的烟囱建造得更高一些,以避免氮氧化物的排放
B. 推广燃煤发电,停建核电站,以防核泄漏事故发生
C. 将废电池深埋,可以避免其中的重金属污染
D. 燃煤中添加CaO,可以减少酸雨的产生
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)对眼和上呼吸道黏膜有强烈的刺激性,但其在工业上有重要作用。其与硫酸的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①遇水易水解,产生大量白雾,生成两种强酸 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 强吸水性、稳定不易分解 |
实验室用干燥纯净的氯气和过量的二氧化硫在活性炭的催化作用下合成硫酰氯,反应方程式为:SO2(g)+Cl2(g)=SO2Cl2(1)H<0,其实验装置如图所示(夹持仪器已省略):

(1)仪器A的名称为____________,冷却水应该从______(填“a”或“b”)口进入。
(2)仪器B中盛放的药品是__________。
(3)实验时,装置戊中发生反应的化学方程式为____________。
(4)若缺少装置乙和丁,则硫酰氯会水解,硫酰氯水解的化学方程式为___________。
(5)反应一段时间后,需在丙装置的三颈瓶外面加上冷水浴装置,其原因是__________。
(6)实验开始时,戊中开始加入12.25gKC1O3,假设KC1O3在过量盐酸作用下完全转化为Cl2,实验结束后得到32.4g纯净的硫酰氯,则硫酰氯的产率为______。
(7)少量硫酰氯也可用氙磺酸(ClSO2OH)直接分解获得,反应方程式为:2ClSO2OH=H2SO4+SO2Cl2。
①在分解产物中分离出硫酰氯的实验操作名称是_____,现实验室提供的玻璃仪器有漏斗、烧杯、蒸发皿、酒精灯、接液管、锥形瓶,该分离操作中还需要补充的玻璃仪器是_____、_____、_____。
②分离出的产品中往往含有少量的H2SO4,请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、紫色石蕊试液):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置不能达到有关实验目的是( )

A. 用甲图装置证明ρ(煤油)< ρ(钠)< ρ(水)
B. 用乙图装置可以吸收氨气防止倒吸
C. 用丙图装置制取金属锰
D. 用丁装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2,工艺流程如下:
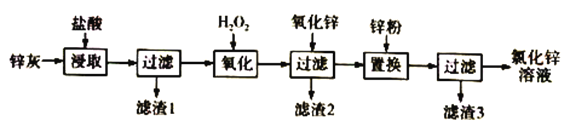
回答下列问题
(1)“浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是________________、____________________。

(2)“滤渣1”的主要成分是_____________。
(3)H2O2溶液的作用是____________________________________,已知“滤渣2”的主要成分是Fe(OH)3,则氧化锌的作用是_______________________________。“置换”实验中发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、___________________________________。
(4)由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2-,则阴极的电极反应为___________________________________。
(5)ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z,为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物M的结构简式如图所示,有关该化合物的叙述不正确的是
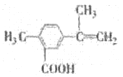
A. 该有机物的分子式为C11H12O2
B. 该有机物的所有碳原子可能处于同一平面上
C. 仅考虑取代基在苯环上的位置变化,M的同分异构体(不包括自身)有9种
D. 该有机物一定条件下只能发生加成反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种新型锂电池装置,电池充、放电反应为xLi+LiV3O8![]() Li1+xV3O8。 放电时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是
Li1+xV3O8。 放电时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极反应为xLi++xe-+LiV3O8=Li1+xV3O8
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是____。
(2)以铝土矿(主要成分为Al2O3.含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下(已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀)。

①实验前,要将铝土矿粉粹的目的是_______。
②用氧化物的形式表示铝硅酸钠的化学式________。
③步骤②涉及到的离子方程式是: _______。
④写出利用Al2O3制备金属Al的化学方程式: _______。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系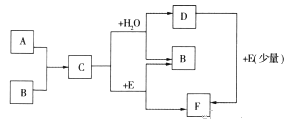
(1)写出A、B、E的化学式:
A , B , E。
(2)完成下列化学反应方程式:
①C+H2O:。
②D+E:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究____________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________作对比(填序号)。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液 ③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸 ⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂________(填序号),现象______________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
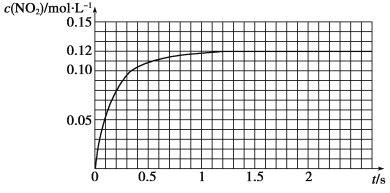
(1)反应容器中最后剩余的物质有______________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com