
【题目】下表为元素周期表的一部分,①~⑩代表10种短周期元素。

请参照元素①~⑩在表中的位置,回答下列问题:
【1】表中属于金属元素的共有 种。
A.2B.3C.5D.8
【2】推测元素③和⑦的非金属性强弱
A.③>⑦B.③<⑦C.③=⑦D.不确定
【3】表中元素化学性质最不活泼的是
A.①B.④C.⑤D.⑩
【4】元素⑨在周期表中的位置为
A.第三周期第七主族B.第三周期第ⅦA族
C.第二周期第七副族D.第三周期第ⅦB族
【5】元素①、③和④形成的化合物
A.一定是共价化合物B.一定是离子化合物
C.可能是共价化合物也可能是离子化合物D.无法判断
【答案】
【1】A
【2】A
【3】D
【4】B
【5】C
【解析】
由元素在元素周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar。
1. 表中⑤为Na、⑥为Al,二者属于金属元素;
2. 同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
3. 稀有气体原子最外层为稳定结构,化学性质稳定;
4. 由位置可知元素⑨在周期表中的位置为:第三周期第ⅦA族;
5. H、N、O形成的化合物有HNO3、NH4NO3等。
【1】表中⑤为Na、⑥为Al,只有这2种元素属于金属元素,故合理选项是A。
【2】同一周期的元素从左到右,随着原子序数的增大,元素的非金属性逐渐增强;同一主族从上到下,元素的非金属性逐渐减弱,故元素的非金属性:③>⑦,故合理选项是A。
【3】⑩为稀有气体Ar,Ar原子最外层为8个电子稳定结构,化学性质最不活泼,故合理选项是D。
【4】元素⑨是Cl元素,根据元素的原子结构与元素在周期表的位置关系可知元素⑨在周期表中位于第三周期第ⅦA族,故合理选项是B。
【5】H、N、O形成的化合物有HNO3、NH4NO2、NH4NO3等,HNO3属于共价化合物,分子中只有共价键,而NH4NO2、NH4NO3属于离子化合物,物质中既含有离子键也含有共价键,故合理选项是C。
本题考查元素周期表与元素周期律,注意根据元素在周期表中的位置确定常见元素的种类,并会分析物质的性质及性质变化规律,本题旨在考查学生对基础知识的掌握。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
①Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子 ,因此还原性Al>Mg;
②氧化剂具有氧化性;
③有单质参加的反应一定是氧化还原反应;
④2Fe+3Cl2![]() 2FeCl3;Fe+S
2FeCl3;Fe+S![]() FeS,由此可以判断氧化性:Cl2>S
FeS,由此可以判断氧化性:Cl2>S
⑤氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
A.②③④ B.②④ C.①②⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如下:
步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq)
下列有关该反应的说法正确的是
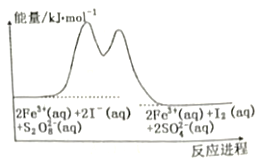
A. 化学反应速率与Fe3+浓度的大小有关
B. 该反应为吸热反应
C. Fe2+是该反应的催化剂
D. 若不加Fe3+,则正反应的活化能比逆反应的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.气体摩尔体积约为22.4 L/mol,一定是在标准状况下
D.18 g H2O在标准状况下的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1NaOH溶液分别滴定20.00mL0.1molL-1的盐酸和苯甲酸溶液,滴定曲线如下图所示,下列说法正确的是

A.图Ⅰ、图Ⅱ分别是NaOH溶液滴定苯甲酸、盐酸的曲线
B.V(NaOH)=10.00mL时,滴定苯甲酸的混合溶液中c(C6H5COO-)> c(Na+)> c(H+)>c(OH-)
C.滴定苯甲酸溶液时最好选用甲基橙作指示剂
D.达到B、D状态时,NaOH溶液分别与盐酸、苯甲酸恰好发生中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3~0.5 g。已知NaNO2能发生如下反应(离子方程式已配平):2![]() +xI-+yH+
+xI-+yH+![]() 2NO↑+I2+zH2O,请回答下列问题:
2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x=___,y=____,z=___,氧化剂是____。
(2)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是___。
A.NaCl B.KMnO4 C.浓硫酸 D.NH4Cl
(3) 饮用水中的![]() 对人类健康会产生危害, 碱性条件下还生成Na[Al(OH)4],为了降低饮用水中的
对人类健康会产生危害, 碱性条件下还生成Na[Al(OH)4],为了降低饮用水中的![]() 浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原
浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原![]() 为N2,请配平化学方程式:___Al+__NaNO3+__NaOH
为N2,请配平化学方程式:___Al+__NaNO3+__NaOH![]() __+__N2↑+__H2O,若反应过程中转移0.5 mol电子,则生成标准状况下的N2体积为____。
__+__N2↑+__H2O,若反应过程中转移0.5 mol电子,则生成标准状况下的N2体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
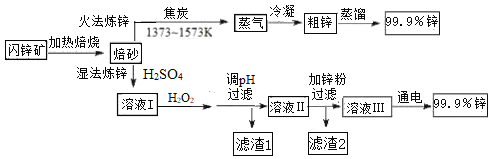
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是
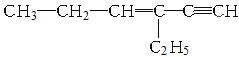
A.1mol该烃完全燃烧消耗O2 11molB.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br2 3molD.分子中一定共平面的碳原子有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点(最中心的点)代表起点元素。下列正确的是( )
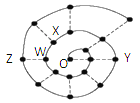
A.物质YO可能具有较强的氧化性
B.图中离O点越远的元素,其原子半径一定越大
C.O2X、WO3分子内都含有氢键,所以沸点都较高
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com