
央视“315特别行动”曝光了河南一些地方“瘦肉精”事件。“瘦肉精”对人体健康会产生危害。已知某种“瘦肉精”含有克伦特罗(Clenbuterol),其结构如下图。下列有关克
伦特罗的叙述,正确的是
 A.该物质的分子式为C12H17ON2Cl
A.该物质的分子式为C12H17ON2Cl
B.该物质不溶于盐酸
C.该物质能与FeCl3溶液发生显色反应
D.该物质分子间都可以形成氢键。
科目:高中化学 来源: 题型:
下列有关同分异构体叙述中正确的是 ( )
A.分子式相同而结构式不同的化合物互称同分异构体
B.组成成分相同而结构式不同的物质互称同分异构体
C.互为同分异构体的物质性质相同
D.互为同分异构体的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )
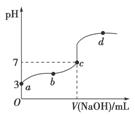
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中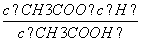 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2A  B+C,在某一温度时,达到平衡。
B+C,在某一温度时,达到平衡。
(1)若温度升高,化学平衡正向移动,则正反应是_____热反应;
(2)若B是固体,降低压强时,平衡逆向移动,则A是_____态;
(3)若A是气态,加压时,平衡不移动,则B为___________态,C为___________态。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| 改变条件 | 新平衡与原平衡比较 | |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:
2HI(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变深
B.恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L
D.恒温、恒压,再通入2molHI气体,到达平衡状态后,HI转化率会提高
查看答案和解析>>
科目:高中化学 来源: 题型:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、
CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、
CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1 请回答下列问题:
⑴ 用太阳能分解18g水,需要消耗的能量为 ▲ kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 ▲ 。
 ⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g)
⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
实验结果如下图所示(注:T1、T2均大于300 ℃):
①下列说法正确的是 ▲
A.温度为T2时,从反应开始到平衡,生成甲醇
的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 ▲ (填字母)。
A.H2的百分含量保持不变 B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变 D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2  2H2O + ▲ 。
2H2O + ▲ 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ▲ ;负极的反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有H、C、O、Cl、Na五种元素。
(1)由两种元素组成的四原子离子化合物的电子式__________________,由两种元素组成的三原子共价化合物的电子式______________。(各写1种)
(2)在由三种元素组成的化合物里,其中离子化合物的化学式_____________,共价化合物的化学式______________________。(组成元素不能完全相同)(各写2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是
A.x=1 B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com