
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、
CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、
CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1 请回答下列问题:
⑴ 用太阳能分解18g水,需要消耗的能量为 ▲ kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 ▲ 。
 ⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g)
⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
实验结果如下图所示(注:T1、T2均大于300 ℃):
①下列说法正确的是 ▲
A.温度为T2时,从反应开始到平衡,生成甲醇
的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 ▲ (填字母)。
A.H2的百分含量保持不变 B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变 D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2  2H2O + ▲ 。
2H2O + ▲ 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ▲ ;负极的反应式为 ▲ 。
科目:高中化学 来源: 题型:
X、Y是元素周期表ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合后,在交换膜处SO 从右向左移动。下列分析不正确的是
从右向左移动。下列分析不正确的是

A.溶液中[A2+]增大 B.B的电极反应:B―→B2++2e-
C.y电极上有Cl2产生,发生氧化反应
D.反应初期x电极周围出现白色沉淀,随后沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
央视“315特别行动”曝光了河南一些地方“瘦肉精”事件。“瘦肉精”对人体健康会产生危害。已知某种“瘦肉精”含有克伦特罗(Clenbuterol),其结构如下图。下列有关克
伦特罗的叙述,正确的是
 A.该物质的分子式为C12H17ON2Cl
A.该物质的分子式为C12H17ON2Cl
B.该物质不溶于盐酸
C.该物质能与FeCl3溶液发生显色反应
D.该物质分子间都可以形成氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:

 ⑴某有机物的键线式是 请写出它与NaOH溶液反应的化学方程式 ▲ :
⑴某有机物的键线式是 请写出它与NaOH溶液反应的化学方程式 ▲ :
⑵DDT人类合成的第一种有机氯农药,其分子结构球棍模型如
右图所示。请分析该物质的核磁共振1H谱图中有 ▲ 个
 吸收峰。
吸收峰。
 ⑶)F和G( ) 是日常生活中常用的两种合成高分子材料,可由某烃 经下列反应得到。
⑶)F和G( ) 是日常生活中常用的两种合成高分子材料,可由某烃 经下列反应得到。
请回答下列问题:
①F的结构简式为 ▲ 。
②C中所含官能团的名称为 ▲ ,用 ▲ 仪,可以测定D中所含官能团。
③A→B的化学方程式为 ▲ 。

 ④已知 2RCH(OH)COOH 2H2O +
④已知 2RCH(OH)COOH 2H2O +
 请参考题目中的合成途径,若合成 ,起始原料的某烃的结构简式为 ▲ ,最少用 ▲ 步反应,可以合成产物。
请参考题目中的合成途径,若合成 ,起始原料的某烃的结构简式为 ▲ ,最少用 ▲ 步反应,可以合成产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的说法中,错误的是( )
A.元素周期表是元素按原子序数从小到大从左到右排列而成的
B.主族元素原子的电子层数等于其所在周期的周期序数
C.四、五、六周期中都含有18种元素,其中Ⅷ族中所含元素种类最多
D.元素周期表中有18列、16个族,且第二列中无非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aX m+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确的是
A.若P>K,则还原性cZP- <dWk-
B.若m > n, 则碱性 X(OH)m > Y(OH)n
C.若半径aX m+>bY n+ ,则a<b
D.若半径aX m+ > bY n+ ,则X的单质一定能从含Y n+ 的盐溶液中置换出Y
查看答案和解析>>
科目:高中化学 来源: 题型:
I.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol 。
。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH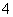 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH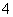 )。
)。
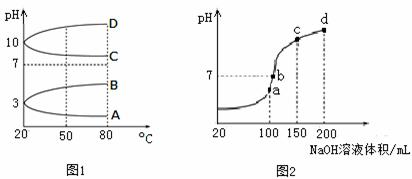
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO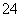 )-c(NH
)-c(NH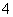 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) XC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,CA:CB=3:5,C的平均速率为0.1mol/L.min。求
XC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,CA:CB=3:5,C的平均速率为0.1mol/L.min。求
(1)此时CA=
(2)反应开始前容器中的A、B的物质的量nA=nB=
(3)B的平均反应速率VB=
(4)X=
(5)此时容器内的压强与反应开始时压强的比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com