
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合后,在交换膜处SO 从右向左移动。下列分析不正确的是
从右向左移动。下列分析不正确的是

A.溶液中[A2+]增大 B.B的电极反应:B―→B2++2e-
C.y电极上有Cl2产生,发生氧化反应
D.反应初期x电极周围出现白色沉淀,随后沉淀消失
科目:高中化学 来源: 题型:
下列说法不正确的是
A.“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用
B.蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学反应8NH3+3Cl2=NH4Cl+N2中,若标准状况下产生2.24 L N2,被氧化物质的物质的量是( )
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )
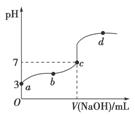
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中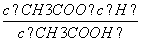 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1mol/L的醋酸溶液中存在下列平衡:CH3COOH  H++CH3COO-,要使该平衡右移且使氢离子浓度增大,应采取的措施是
H++CH3COO-,要使该平衡右移且使氢离子浓度增大,应采取的措施是
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2A  B+C,在某一温度时,达到平衡。
B+C,在某一温度时,达到平衡。
(1)若温度升高,化学平衡正向移动,则正反应是_____热反应;
(2)若B是固体,降低压强时,平衡逆向移动,则A是_____态;
(3)若A是气态,加压时,平衡不移动,则B为___________态,C为___________态。
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| 改变条件 | 新平衡与原平衡比较 | |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、
CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、
CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1 请回答下列问题:
⑴ 用太阳能分解18g水,需要消耗的能量为 ▲ kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 ▲ 。
 ⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g)
⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
实验结果如下图所示(注:T1、T2均大于300 ℃):
①下列说法正确的是 ▲
A.温度为T2时,从反应开始到平衡,生成甲醇
的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 ▲ (填字母)。
A.H2的百分含量保持不变 B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变 D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2  2H2O + ▲ 。
2H2O + ▲ 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ▲ ;负极的反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,反应aX(g)  bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的
bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的 ,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
A.a>b+c B.a=b+c C.a<b+c D.a=b=c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com