
X、Y是元素周期表ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5 ,a = 10 C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用
B.蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关同分异构体叙述中正确的是 ( )
A.分子式相同而结构式不同的化合物互称同分异构体
B.组成成分相同而结构式不同的物质互称同分异构体
C.互为同分异构体的物质性质相同
D.互为同分异构体的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒具有相同的质子数和电子数的是( )
A.CH4、NH3、H2 B.OH-、F-、Ne
C.H3O+、NH4+、Na+ D.O2-、F-、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学反应8NH3+3Cl2=NH4Cl+N2中,若标准状况下产生2.24 L N2,被氧化物质的物质的量是( )
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )
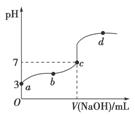
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中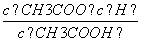 相等
相等
查看答案和解析>>
科目:高中化学 来源: 题型:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、
CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、
CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1 请回答下列问题:
⑴ 用太阳能分解18g水,需要消耗的能量为 ▲ kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 ▲ 。
 ⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g)
⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
实验结果如下图所示(注:T1、T2均大于300 ℃):
①下列说法正确的是 ▲
A.温度为T2时,从反应开始到平衡,生成甲醇
的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 ▲ (填字母)。
A.H2的百分含量保持不变 B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变 D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2  2H2O + ▲ 。
2H2O + ▲ 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ▲ ;负极的反应式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com