
对可逆反应4NH3(g) + 5O2(g) 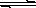 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.化学反应速率关系是:2υ正(NH3) = 3υ正(H2O)
B.达到化学平衡时,4υ正(O2) = 5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:2015-2016学年福建省宁德市高二上期中(理)化学试卷(解析版) 题型:选择题
有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
A、增加X的量 B、使用催化剂 C、升高温度 D、增大压强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省华士、成化、山观三校高二上期中必修化学试卷(解析版) 题型:选择题
下列实验中,始终无明显现象的是
A、NH3通入AlCl3溶液中
B、SO2通入HNO3酸化的Ba(NO3)2溶液中
C、NO2通入FeSO4溶液中
D、CO2通入CaCl2溶液中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西八一、洪都、麻丘中学等高二上期中联考化学试卷(解析版) 题型:选择题
下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 大理石 | 玻璃 | 氯化钾 | 高氯酸 | 干冰 |
B | 盐酸 | 水煤气 | 硫酸 | 醋酸 | 氯气 |
C | 明矾 | 硅酸盐水泥 | 苛性钠 | 亚硫酸 | 熟石灰 |
D | 冰醋酸 | 漂白粉 | BaSO4 | 氟化氢 | 氨气 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:甲同学利用Al、Fe、Mg和2 mol/L的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是_______________________;要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5 mol/L及2 mol/L的足量稀H2SO4反应,通过________可以说明浓度对化学反应速率的影响。

实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2983.2 kJ·mol-1①
P(s,红磷)+5/4O2(g)===1/4 P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为 。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
实验室里有4个药品橱,已经存放以下物品:
药品厨 | 甲橱 | 乙橱 | 丙橱 | 丁厨 |
药品 | 盐酸 ,硫酸 | 氢氧化钠 ,氢氧化钙 | 红磷,硫 | 铜,锌 |
实验室新购进一些碘,应该将这些碘放在
A.甲橱 B.乙橱 C.丙橱 D.丁橱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省宣城、郎溪、广德三校高二上期中联考化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体
b.适当升高温度
c.增大CO2的浓度
d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
A.容器中压强不变
B.混合气体中 c(CO)不变
C.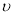 正(H2)=
正(H2)= 逆(H2O)
逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 ,CO2的物质的量为 。
A.等于1.0mol
B.大于1.0mol
C.大于0.5mol,小于1.0mol
D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上学期期中测试化学试卷(解析版) 题型:实验题
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
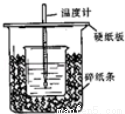
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________.
(2)烧杯间填满碎纸条的作用是__________.
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量___________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由_______ _.
(5)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X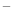 与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
A.微粒半径:X<X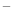
B.简单氢化物的稳定性:Z比W的强
C.W的氧化物的水化物的酸性一定比Z的强
D.最外层电子数由大到小的顺序为:Z、 W、Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com