
��һ��������ܱ������У��������»�ѧ��Ӧ��
CO2(g) �� H2(g)  CO(g) �� H2O(g)���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO(g) �� H2O(g)���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
T/�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�ӦΪ ��Ӧ������ȡ��������ȡ�����
��2����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����� ��
a����ʱ�����CO����
b���ʵ������¶�
c������CO2��Ũ��
d��ѡ���Ч����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� (��ѡ���÷�)��
A��������ѹǿ����
B����������� c(CO)����
C�� ��(H2)��
��(H2)�� ��(H2O)
��(H2O)
D��c(CO2)��c(CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ�� c(CO2)��c(H2)��c(CO)��c(H2O)�����жϴ�ʱ���¶�Ϊ �档
��5�����ڣ�4���������¶��£���1L���ܱ������У�����2molCO2��3molH2��ַ�Ӧ��ƽ��ʱ��H2�����ʵ���Ϊ ��CO2�����ʵ���Ϊ ��
A������1.0mol
B������1.0mol
C������0.5mol����1.0mol
D����ȷ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�ĵ���У�߶���ѧ��10��һ��������ѧ�Ծ��������棩 ���ͣ������
��Ȼ����â����ѧʽΪNa2SO4��10H2O��Ϊ��ɫ���壬������ˮ����С��ͬѧ���룬���ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������ͼ��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ���
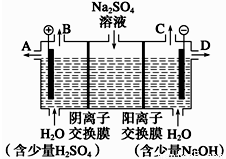
��1���õ��۵������缫��ӦʽΪ ����ʱͨ�������ӽ���Ĥ��������__________(����ڡ�����С�ڡ����ڡ�)ͨ�������ӽ���Ĥ����������
��2�����õ���Ũ����������Һ�ӳ���(�A������B������C����D��)________������
��3�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ���õ�ظ����ĵ缫��ӦʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��ʿ���ɻ���ɽ����У��һ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ʹ�á���¼�����ݻ�ʵ��Ľ�����ȷ����
A����25mL��Ͳ��ȡ22.30mL����
B����������ƽ����8.75gʳ��
C����20gNa2CO3����80gˮ���Ƶ�20%��Na2CO3��Һ
D������״����22.4LHCl��������1Lˮ�п��Ƶ�1mol/L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����������ھ���ѧ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�Կ��淴Ӧ4NH3(g) + 5O2(g) 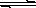 4NO(g) + 6H2O(g)������������ȷ����
4NO(g) + 6H2O(g)������������ȷ����
A����ѧ��Ӧ���ʹ�ϵ�ǣ�2����(NH3) = 3����(H2O)
B���ﵽ��ѧƽ��ʱ��4����(O2) = 5����(NO)
C���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ��٣��淴Ӧ��������
D������λʱ��������x mol NO��ͬʱ������x mol NH3 ����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ������ѧ�����нβ��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��1����ҵ�Ʊ�����������ͼ1��

������β���е�NOһ�������¿��백����Ӧת��Ϊ��������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��ijͬѧ��ʵ����������Mg��NO3��2��ϡ������ȡŨ���ᣬ�����ܡ��ƾ��ơ�ţ�ǹܡ���ƿ���¶ȼơ�������ƿ�⣬����IJ��������� ��
��2��ij��ȤС�������ͼ2װ����ȡ��̽��SO2��������ʣ�
������ʵ�鷽����������ͼ2��ʾװ����ȡ����SO2���� ������ţ�
A��Na2SO3��Һ��HNO3 B��Na2SO3������Ũ����
C���������ڴ�����ȼ�� D��ͭ��ŨH2SO4
�ڽ�SO2ͨ�뵽��������ɫ����Һ�У���Һ����ɫ����ȥ����������Ư���� ��
A����ɫ���������Һ B����ˮ C��Ʒ����Һ D����ɫ��̪��Һ
��֤��c������������SO2��d�м���Ʒ����Һ����b����Ӧ��ʼ����d����Һ ���� ����ʵ��IJ������Թ�d�е���Һ����ɫ�ָֻ���֤��������SO2��
��ָ����ʦָ��Ӧ����һβ������װ�ã�������ͬѧ�����������װ�ã����к������� ������ţ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�ĵ���У�߶���ѧ��11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
ijѧϰС��Ϊ��̽�� BrO3�� + 5Br�� + 6H+ = 3Br2 + 3H2O ��Ӧ���ʣ�v���뷴Ӧ��Ũ�ȵĹ�ϵ����20�����ʵ�飬���õ��������±�,���н��۲���ȷ����
ʵ���� ������� | �� | �� | �� | �� | �� |
c(H+)/ mol �� L��1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3��)/ mol�� L��1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br��)/ mol�� L��1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v / mol�� L��1�� s��1 | 2.4��10-8 | 4.8��10-8 | 1.2��10-8 | 4. 8��10-8 | v1 |
A�����¶����ߵ�40�棬��Ӧ��������
B��ʵ��ڡ��ܣ�̽������c(BrO3��)�Է�Ӧ���ʵ�Ӱ��
C�����÷�Ӧ���ʷ���Ϊv = k ca(BrO3��)cb(Br��)cc(H+)��kΪ����������c = 2
D��ʵ����У�v1 = 4.8��10-8 mol�� L��1�� s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�˲��и�һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�⻯�ƿ�����Ϊ�����(����CaH2����Ԫ��Ϊ��1��)����Ӧ����ʽ���£�
CaH2+2H2O=Ca(OH)2+2H2��������ˮ��������
A���Ȳ���������Ҳ���ǻ�ԭ��
B����������
C���ǻ�ԭ��
D���������������ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ������
��Ҫ��д���й�������ԭ��Ӧ�Ļ�ѧ����ʽ��
��1���ǻ��Ϸ�Ӧ��Ҳ��������ԭ��Ӧ_________��
��2���ǷֽⷴӦ��Ҳ��������ԭ��Ӧ_________��
��3���н�������Ag���ɵ��û���Ӧ__________��
��4�����������ֻ�����Ӧ���͵�������ԭ��Ӧ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶�������������ѧ�Ծ��������棩 ���ͣ������
�����ѣ�CH3OCH3������ɫ���壬����Ϊһ��������Դ���ɺϳ��������ΪH2��CO��������CO2��ֱ���Ʊ������ѣ����е���Ҫ���̰��������ĸ���Ӧ�� �״��ϳɷ�Ӧ��
��i��CO(g) + 2H2(g) = CH3OH(g) ��H1 = -90.1kJ•mol-1
��ii��CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ��H2 = -49.0kJ•mol-1
ˮú���任��Ӧ��
��iii��CO(g) + H2O(g) = CO2(g) + H2 (g) ��H3 = -41.1kJ•mol-1
�����Ѻϳɷ�Ӧ��
��iV��2 CH3OH(g) = CH3OCH3(g) + H2O(g) ��H4 = -24.5kJ•mol-1
��1�����������Ѻϳɷ�Ӧ��iV������COת���ʵ�Ӱ�� ��
��2����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ ���ݻ�ѧ��Ӧԭ������������ѹǿ��ֱ���Ʊ������ѷ�Ӧ��Ӱ���� ��
��3�����о����ڴ�������Cu��Zn��Al��O��Al2O3����ѹǿΪ5.0MPa�������£���H2��COֱ���Ʊ������ѣ��������ͼ��ʾ������COת�������¶����߶����͵�ԭ���ǣ� ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com