
(1)工业制备硝酸流程如图1:

①上述尾气中的NO一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为 .
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶、温度计、蒸馏烧瓶外,还需的玻璃仪器有 .
(2)某兴趣小组采用如图2装置制取并探究SO2气体的性质.
①下列实验方案适用于如图2所示装置制取所需SO2的是 (填序号)
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4
②将SO2通入到以下有颜色的溶液中,溶液的颜色均褪去,其中属于漂白的是 。
A.紫色高锰酸钾溶液 B.氯水 C.品红溶液 D.红色酚酞溶液
③证明c中生成气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液 后,再 (填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2.
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是 (填序号)

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:2015-2016学年福建省宁德市高二上期中(文)化学试卷(解析版) 题型:选择题
铝粉和氧化铁粉末在高温条件下发生铝热反应,该反应放出大量的热,用于焊接铁轨。反应的化学方程式为:2Al+Fe2O3 2Fe+Al2O3 ,对该反应的下列说法正确的是
2Fe+Al2O3 ,对该反应的下列说法正确的是
A.Fe2O3是氧化剂
B.铁元素的化合价升高
C.Fe2O3中铁元素的化合价为+2价
D.Fe2O3发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省华士、成化、山观三校高二上期中选修化学试卷(解析版) 题型:选择题
下列有关物质的表达式不正确的是
A.乙烯的结构简式:CH2 CH2
B. CS2分子的结构式:S═C═S
C. 醛基的结构简式:﹣CHO
D. 羟基的电子式:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川第九中学高二上学期期中测试化学试卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:甲同学利用Al、Fe、Mg和2 mol/L的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是_______________________;要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5 mol/L及2 mol/L的足量稀H2SO4反应,通过________可以说明浓度对化学反应速率的影响。

实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2983.2 kJ·mol-1①
P(s,红磷)+5/4O2(g)===1/4 P4O10(s) ΔH2=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为 。相同状况下,能量状态较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:填空题
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验:
①将该粉末溶于水得无色溶液和白色沉淀;
②在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体;
③取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:(1)该混合物中一定含有 ;一定不含有 。
(2)该混合物中可能含有 ,请设计实验证明其是否存在 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省宣城、郎溪、广德三校高二上期中联考化学试卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体
b.适当升高温度
c.增大CO2的浓度
d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
A.容器中压强不变
B.混合气体中 c(CO)不变
C.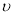 正(H2)=
正(H2)= 逆(H2O)
逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 ,CO2的物质的量为 。
A.等于1.0mol
B.大于1.0mol
C.大于0.5mol,小于1.0mol
D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期11月联考化学试卷(解析版) 题型:选择题
NH4HS(s) NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是
NH3(g)+H2S(g)在一定温度下达到平衡,下列情况不能使平衡发生移动的是
A.温度、容积不变,充入NH3
B.温度、容积不变时,充入SO2气体
C.充入N2,保持压强不变
D.移走一部分NH4HS固体
查看答案和解析>>
科目:高中化学 来源:2016届山东省潍坊市高三上学期期中测试化学试卷(解析版) 题型:选择题
一定条件下,自然界中存在反应:14CuSO4+5FeS2+12H2O==7Cu2S+5FeSO4+12H2SO4。下列说法不正确的是
A.Cu2S既是氧化产物又是还原产物
B.FeS2既作氧化剂,又作还原剂
C.5 mol FeS2发生反应,有21 mol电子转移
D.产物中的SO42-有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.强电解质溶液不一定比弱电解质溶液的导电性强
C.盐酸、氢氧化钠、硫酸钡和氧化铝一定是强电解质
D.强、弱电解质的导电性由溶液中溶质的浓度决定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com