
 ,
, ;
;| 1 |
| 2 |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、Ca2+、Al3+、Br-、CO32- |
| B、Pb2+、Hg2+、S2-、SO3- |
| C、NH4+、H+、S2O32-、PO43- |
| D、Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4是钠盐、硫酸盐、正盐 |
| B、HCl是一元酸、强酸、挥发性酸 |
| C、Fe2O3是金属氧化物、最高价氧化物、碱性氧化物 |
| D、Ca(OH)2是二元碱、微溶性碱、强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
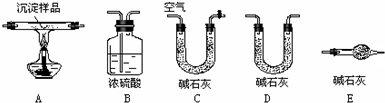
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅根据实验①能说明还原性:Br->Cl- |
| B、仅根据实验②能说明氧化性:Br2>I2 |
| C、上述实验验证了Cl2、Br2、I2的氧化性相对强弱 |
| D、向实验③所得溶液中加CCl4,充分振荡,下层为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
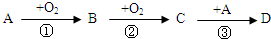
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com