
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
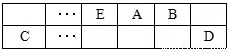
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
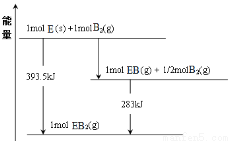
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。
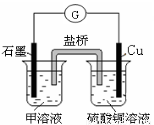
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
(1)NH3·H2O NH4+ + OH- (2)> (3)Al(OH)3(4) ①③
NH4+ + OH- (2)> (3)Al(OH)3(4) ①③
(5)Na3N + 4H2O=3NaOH + NH3·H2O
(6)CO2(g) + C(s) = 2CO(g) ;△H= +172.5kJ/mol
或1/2CO2(g) + 1/2 C(s) = CO(g); △H= +86.25kJ/mol (7) Fe3++e-→Fe2+
【解析】
试题分析:根据题意可推知:A是N;B是O;C是Na;D是Cl;E是C;F是Al;G是Fe。(1)NH3的水溶液显碱性,是因为在溶液中存在:NH3+H2O NH3·H2O; NH3·H2O
NH3·H2O; NH3·H2O NH4+ + OH-;(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b。(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾。(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O. (6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) = 2CO(g) ;△H= +172.5kJ/mol。(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-→Fe2+。
NH4+ + OH-;(2)NH3+HCl=NH4Cl;若二者等体积混合,则恰好发生反应得到NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,现在所得溶液的pH=7,溶液显中性,所以氨气要过量。因此a>b。(3)Al(OH)3完全沉淀的pH是4.7,Fe(OH)3完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Fe(OH)3先生成沉淀,结构相似的物质,ksp越小的,越易先生成沉淀,这说明kspAl(OH) 3>kspFe(OH) 3,因此ksp较大的是Al(OH)3;(4)A与B可组成质量比为7:16的三原子分子NO2,该分子释放在空气中其化学作用可能引发的后果①酸雨;③光化学烟雾。(5)A和C组成的一种离子化合物Na3N,能与水反应生成两种碱,该反应的化学方程式是Na3N + 4H2O=3NaOH + NH3·H2O. (6)由物质的能量及相互转化关系可得方程式为:CO2(g) + C(s) = 2CO(g) ;△H= +172.5kJ/mol。(7)若在Cl与Fe组成的某种化合物FeCl3的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为Fe3++e-→Fe2+。
考点:考查元素的推断、物质的性质、相互转化、影响及化学方程式、热化学方程式的书写、原电池的设计及反应原理的知识。


科目:高中化学 来源:2013-2014福建省漳州市八校高三第四次联考理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
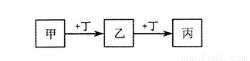
下列说法不正确的是
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Fe,则丁可能是Cl2
C.若丁是CO2,则甲可能为Mg
D.若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
下列有关实验的说法不正确的是
A.取用液溴时,应戴上橡皮手套
B.配制一定物质的量浓度的NaCl溶液时,NaCl应在烧杯中溶解
C.加热乙酸、乙醇、浓硫酸的混合物制备乙酸乙酯时,应加入2~3块碎瓷片
D.无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:填空题
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为________________。
(2)上述反应生成物中,属于非电解质的是________。
(3)上述反应中,每生成1 mol氧化产物,消耗KNO3的质量为 (保留1位小数)。
(4)收集黑火药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质是 (填化学式)。
②气体产物与酸性高锰酸钾溶液反应的离子方程式 。
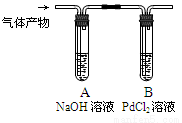
③利用下图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:选择题
次氯酸钠能有效地杀灭水中的细菌和病毒。该过程不可能涉及的变化有
A.置换反应 B.复分解反应 C.电离 D.水解
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的数值,下列说法正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2 NA时,阴极析出4 g金属
B.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
C.常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4 L
D.在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
已知:N2O4(g)  2NO2(g) ΔH=+57.20kJ · mol-1
2NO2(g) ΔH=+57.20kJ · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1) 该反应的平衡常数表达式为 ______;从表中数据分析:
c1 c2 (填“>” 、“<” 或“=” )。
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质的水溶液在适当加热时酸性增强的是
A.氯化铁 B.氯化钠 C.盐酸 D.碳酸钠
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C. 稀硝酸 D. 硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com