
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
分析 X、Y、Z、W、Q都是短周期主族元素,其中X是短周期原子半径最大的元素,则X为Na;X与Y处于同一周期,Y与Z同主族且能形成两种常见的化合物,则Y为S元素、Z为O元素;W能形成两种简单的离子,则W为H元素;Q原子的电子总数等于其电子层数的3倍,原子只能有2个电子层,核外电子数为6,故Q为C元素,据此解答.
解答 解:X、Y、Z、W、Q都是短周期主族元素,其中X是短周期原子半径最大的元素,则X为Na;X与Y处于同一周期,Y与Z同主族且能形成两种常见的化合物,则Y为S元素、Z为O元素;W能形成两种简单的离子,则W为H元素;Q原子的电子总数等于其电子层数的3倍,原子只能有2个电子层,核外电子数为6,故Q为C元素.
A.元素Q为碳元素,不是短周期非金属性最强的元素,短周期中非金属最强的元素为F元素,故A错误;
B.Y、Z形成的化合物为二氧化硫、三氧化硫,均属于酸性氧化物,故B错误;
C.Y、Z、Q分别与W形成的化合物为氢化物,分别为硫氢化、水、均为,由于水分子之间存在氢键,沸点最高,故C正确;
D.Na与氧元素形成的过氧化钠中既含离子键又含共价键,故D正确,
故选:CD.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意能形成两种简单的离子的元素,难度中等.


科目:高中化学 来源: 题型:解答题
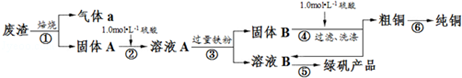

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
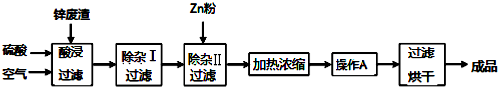
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀的 pH | 3.3 | 1.5 | 6.5 | 5.4 | 4.2 |
| 沉淀完全的 pH | 5.2 | 3.7 | 9.7 | 8.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 | |
| D. | 烧过菜的铁锅加入清水放置,出现红棕色的锈斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 取a克混合物充分加热至质量不变,减重b克 | |
| B. | 取a克混合物与足量稀硝酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰完全吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
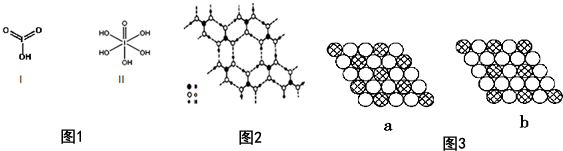
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们使用合金是因为它比纯金属具有更优良的化学性质 | |
| B. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| C. | 高分子材料可能在特殊情况导电,如聚乙炔 | |
| D. | 可用作荧光灯内壁保护层的纳米氧化铝属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
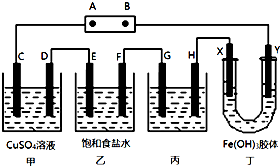 某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com