
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
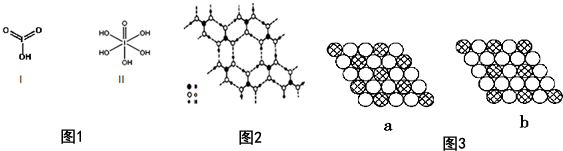
分析 (1)根据基态原子核外电子排布式中最后填入电子名称确定区域名称,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)根据氢键分析解答;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)利用均摊法计算含1molH3BO3的晶体中的氢键;硼酸B(OH)3•H2 O,它电离生成少量[B(OH)4]一和H+,阴离子中含O-H共价键及B提供空轨道和O提供电子的配位键;
(6)二维平面晶体示意图中,黑球周围均有6个白球,但a中白球周围有3个黑球,b中白球周围有2个黑球.
解答 解:(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤族元素位于元素周期表的P区;溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为:4s24p5,故答案为:P;4s24p5;
(2)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:碘;
(4)H5IO6(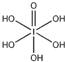 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO3为一元酸,含有1个羟基氢,含非羟基氧原子2个,所以酸性:HIO3>H5IO6,
故答案为:>;
(5)1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,[B(OH)4]一含有的化学键类型为共价键和配位键,故答案为:3;共价键、配位键;
(6)二维平面晶体示意图中,黑球周围均有6个白球,但a中白球周围有3个黑球,b中白球周围有2个黑球,则b中化学式为AX3,故答案为:b.
点评 本题考查较综合,涉及晶胞计算、电子排布、化学键等,侧重物质结构与性质的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$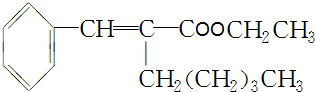 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
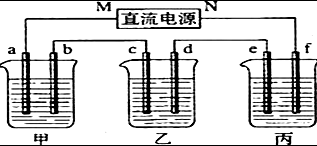 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | CO2 | C. | HNO3 | D. | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正方应为吸热反应 | |
| B. | 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 | |
| C. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16种 | B. | 8种 | C. | 4种 | D. | 2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com