
【题目】下列说法中,正确的是
A.增大反应物浓度,平衡正向移动,反应物的转化率一定增大
B.正、逆反应速率改变时,平衡一定发生移动
C.对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡
D.增大体系压强,化学反应速率加快,化学平衡一定正向移动
科目:高中化学 来源: 题型:
【题目】关于气体摩尔体积的下列叙述中正确的是 ( )
A. 气体摩尔体积是单位物质的量的气体所占的体积
B. 标准状况下,气体摩尔体积约为22.4 L
C. 标准状况下,1 mol任何物质所占的体积约是22.4 L
D. 标准状况下,1 mol氢气所占的体积约是22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀废水中常含有剧毒的NaCN,可用两段氧化法处理:
①第一段:NaCN+NaClO→NaOCN+NaCl
②第二段:2NaOCN+3NaClO→Na2CO3+CO2↑+3NaCl+N2↑
完成下列填空:
(1)上述反应涉及的元素中,氮原子核外价电子数是______个;
O2—、Na+、Cl—中半径最小的是_____________。
(2)NaCN晶体中含有的化学键类型为_____________________________。
(3)第二段过程中,产物属于双原子分子的结构式是___________,该物质一般要比其他共价化合物如:NH3、H2S等都要稳定,其原因为:___________________;写出该物质的一种用途:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-10,下列叙述正确的是
=1×10-10,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合,所得混合溶液中水的电离得到促进
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol·L-1的溶液
C.能够与Na反应生成H2的溶液
D.电解食盐水最后所得溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含少量硫酸铁的硫酸钠固体,制取芒硝(Na2SO4·10H2O),操作流程图如下所示,请回答下列问题:
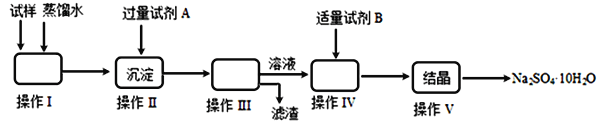
(1)操作I的名称是________;操作III所需的玻璃仪器有________________________。
操作V的步骤依次是________(用编号填入)
过滤 b.冷却 c.蒸发浓缩 d.蒸发至接近蒸干
(2)试剂A为__________;试剂B为__________,加入试剂B的目的是__________________,实验中加入适量试剂B的实验方案为___________________。
测定所得产品中结晶水含量的实验过程及数据如下,完成下列填空:
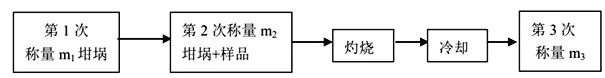
(3)计算所得产品中结晶水含量的表达式为___________________
(4)下列操作会导致结果偏高的是______________(选填编号)
a.坩埚未干燥 b.加热过程中有晶体溅失 c.晶体中含不挥发杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是

A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现某些金属离子如 Fe3+、Cu2+等对H2O2的分解也具有催化作用,为了比较 MnO2与 Fe3+和Cu2+的催化效果,某同学设计了如图甲、乙所示的实验。
请回答相关问题:
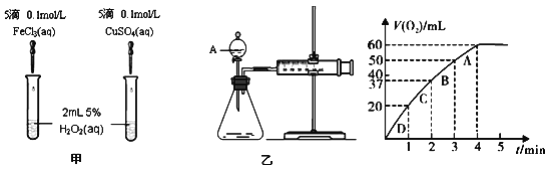
(1)定性分析:图甲可通过观察__________(填写相关实验现象), 定性比较得出结论。有同学提出将FeCl3 改为 Fe2(SO4)3 或者将 CuSO4 改为 CuCl2 更为合理,其理由是______________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。检查乙装置气密性的方法是_____________,实验中需要测量的数据是___________。
(3)加入0.10mol MnO2 粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①实验时放出气体的总体积是_______mL, 反应放出气体所需时间约为_________min。
②A、B、C、D各点反应速率快慢的顺序为 D>C>B>A.解释反应速率变化的原因:______________。
③计算 H2O2 的初始物质的量浓度为__________mol/L。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)某实验小组在实验室模拟上述反应。一定温度下,在2L盛有Fe2O3粉末的恒容密闭容器中通入0.1molCO,5min时生成2.24gFe。5min内有CO表示的平均反应速率是______________mol·L-1min-1;5min时CO2的体积分数为___________;若将此时反应体系中的混合气体通入100mL0.9mol/L的NaOH溶液中,充分反应后所得溶液中离子浓度由大到小的顺序是__________________ 。
(2)上述反应的平衡常数表达式为:K=_______________;下列能说明该反应已经达到平衡状态的是_____________(填序号)。
a.容器内固体质量保持不变
b.容器中气体压强保持不变
c.c(CO)=c(CO2)
d.v正(CO)=v逆(CO2)
(3)已知上述反应的平衡常数K与温度T(单位:K)之间的关系如图所示,其中直线的斜率为-![]() (气体常数R=8.3×10-3kJ·mol-1·K-1)。
(气体常数R=8.3×10-3kJ·mol-1·K-1)。
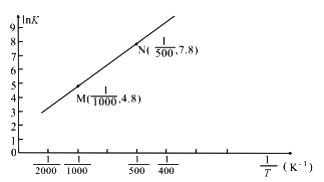
①根据图像可知,该反应的平衡常数随温度升高而____________(填“增大”、“减小”或“不变”)
②该反应的△H=_______________kJ·mol-1。
(4)结合上述有关信息,写出两条提高CO转化率的措施_____________、_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com