
������ѧ��ѧ��Ӧԭ��������������⣺
(1) ij��Һ��������ͬ���ʵ��������ʣ�����ֻ����OH����H����NH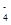 ��Cl���������ӣ���c(NH
��Cl���������ӣ���c(NH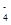 )>c(Cl��)>c(OH��)>c(H��)����������������________��
)>c(Cl��)>c(OH��)>c(H��)����������������________��
(2) ��֪��Ksp(RX)��1.8��10��10��Ksp(RY)��1.5��10��16��Ksp(R2Z)��2.0��10��12����������RX��RY��R2Z�ı�����Һ�У�R��Ũ���ɴ�С��˳����________________________________��
(3) ��ʯī�缫���100 mL 0.1 mol��L��1 CuSO4��Һ���������ϲ�����������ʵ���Ϊ0.01 mol��������������Cu������Ϊ______g��
(4) ��������Һ���μ���Ba(OH)2��Һ����������Ӹպó�����ȫʱ����Һ��pH 7������������������������ӷ�Ӧ�ܷ���ʽΪ_______________________________________����������Һ���μ���Ba(OH)2��Һ�������Ӹպó�����ȫʱ����Һ��pH 7������������������������ӷ�Ӧ�ܷ���ʽΪ ��
����12�֣�
(1) NH4Cl��NH3��H2O ��2�֣� (2) R2Z>RX>RY��2�֣� (3) 0.64��2�֣�
(4) pH��7��1�֣� Al3++2SO42-+2Ba2++4OH�� �� AlO2��+2BaSO4��+2H2O ��2�֣�
pH ="7" ��1�֣� 2Al3++3SO42��+3Ba2++6OH�� �� 2Al(OH)3��+3BaSO4����2�֣�
��������
�����������1������ҺΪNH4Cl������Һ�д���c��Cl-����c��NH4+����c��H+����c��OH-��������ҺΪNH3��H2O������Һ�д���
c��NH4+��c��OH-����c��H+������c��NH4+����c��Cl-����c��OH-����c��H+������ӦΪNH4Cl�� NH3��H2O�Ļ���
�ʴ�Ϊ��NH4Cl�� NH3��H2O��
��2����Ksp��RX��=1.8��10-10��Ksp��RY��=1.5��10-16��Ksp��R2Z��=2.0��10-12��֪��
RX��Һ��c��R+��= 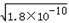 ��RY��Һ��c��R+��=
��RY��Һ��c��R+��= 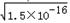 ��R2Z��Һ��c��R+��=
��R2Z��Һ��c��R+��= 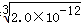 ��
��
��R+Ũ���ɴ�С��˳����R2Z��RX��RY��
�ʴ�Ϊ��R2Z��RX��RY��
��3�����CuSO4��Һ��������ӦΪ��Cu2++2e-=Cu��������ӦΪ��2H2O-4e-=4H++O2����
��Cu��ȫ����ʱ������n��O2��=(1/2)��0.01mol=0.005mol������ʱ����������0.01mol���壬�����Cu��ȫ�������������ϻ�������2H++2e-=H2�����������ɵ�ͭΪm��Cu��=0.01mol��64g/mol=0.64g��
�ʴ�Ϊ��0.64��
(4)�����������Һ��pH��7�����ӷ�Ӧ�ܷ���ʽΪAl3++2SO42-+2Ba2++4OH�� �� AlO2��+2BaSO4��+2H2O���Ӧ�꣬��pH =7�����ӷ�Ӧ�ܷ���ʽΪ2Al3++3SO42��+3Ba2++6OH�� �� 2Al(OH)3��+3BaSO4����
���㣺�����ʱ�Ķ����жϼ��й�ph�ļ��� ��ѧƽ��ļ��� ���������ˮ��Һ�еĵ���ƽ�� ����ˮ���Ӧ�� ���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���
���������⿼���Ϊ�ۺϣ��漰������ʵĵ��롢�����ˮ�⡢���ܵ���ʵ��ܽ�ƽ�⡢�绯ѧ�Լ���ѧƽ��֪ʶ����Ŀ�ѶȽϴ����״���Ϊ��6����ע��ӵ�Чƽ��ĽǶȷ�����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?֣�ݶ�ģ��������ѧ��ѧ��Ӧԭ��������������⣺
��2011?֣�ݶ�ģ��������ѧ��ѧ��Ӧԭ��������������⣺| H | + 4 |
| H | + 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol H2��1mol I2 | 2 mol HI | 4 mol HI |
| HI��Ũ�ȣ�mol?L-1�� | C1 | C2 | C3 |
| ��Ӧ�������仯 | �ų�akJ | ����bkJ | ����ckJ |
| ��Ӧ��ת���� | a1 | a2 | a3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ѧ��ѧ��Ӧԭ��������������⣺
��1��ij��Һ��������ͬ���ʵ��������ʣ�������ֻ����OHһ��H����![]() ��Clһ�������ӣ���c��
��Clһ�������ӣ���c��![]() ��>c��Cl����>c��OH����>c��H��������������������_____________��
��>c��Cl����>c��OH����>c��H��������������������_____________��
��2��0��1 mol��L��1�İ�ˮ��0��05 mol��L��1��ϡ����������ϣ������ӷ���ʽ��ʾ��Ϻ���Һ������ԣ�______________________��
��3����֪��Ksp��RX����1��8��10��10��Ksp��RY����1��5��10��16��Ksp��R2Z����2��0��10��12����������RX��RY��R2Z�ı�����Һ�У�R��Ũ���ɴ�С��˳����_____________��
��4����ʯī�缫���100 mL 0��1 mol��L��1CuSO4��Һ���������ϲ�����������ʵ���Ϊ0��01 mol��������������Cu������Ϊ__________g��
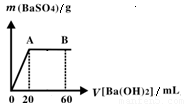
��5����20 mL���������Ļ��Һ����μ���pH��13��Ba��OH��2��Һ������BaSO4��������ͼ��ʾ��B����Һ��pH��7�������������ֱ����ӣ�����c��HCl����_______mol��L��1.

��6�����¶ȡ��ݻ���ͬ��3���ܱ������У����±�Ͷ�뷴Ӧ�������Ӧ��H2��g����I2��g��![]() 2HI��g�� ��H����14��9 kJ��mol��1�����ں��¡����������£���÷�Ӧ�ﵽƽ��ʱ���������±���
2HI��g�� ��H����14��9 kJ��mol��1�����ں��¡����������£���÷�Ӧ�ﵽƽ��ʱ���������±���

����˵����ȷ����_______________��
A��![]() ��
��![]() ��1 B��2
��1 B��2![]() ��
��![]() C��a��b��14��9 D��c1��c2��c3
C��a��b��14��9 D��c1��c2��c3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ֣���и߶���ѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ������
��10�֣� ������ѧ��ѧ��Ӧԭ��������������⣺
��1��ij��Һ��������ͬ���ʵ��������ʣ���Һ��ֻ����OH����H����NH4����Cl���������ӣ���c��NH4������c��Cl������c��OH������c��H�������������������� _________ ��
��2��0.1 mol��L-1�İ�ˮ��0.05 mol��L-1��ϡ����������ϣ������ӷ���ʽ��ʾ��Ϻ���Һ������ԣ� ��
��3����ʯī�缫���100 mL 0.1 mol��L-1CuSO4��Һ���������ϲ�����������ʵ���Ϊ0.01 mol��������������Cu������Ϊ g��
��4����AgCl�ֱ�����5mL H2O ��10mL0.2mol��L-1 MgCl2 ��20 mL0.5mol��L-1 NaCl��Һ ��40 mL0.1mol��L-1HCl���ܽ������ͣ�����Һ��Ag+��Ũ���ɴ�С��˳����________________��
��5����20 mL���������Ļ��Һ����μ���pH��13��Ba(OH)2��Һ������BaSO4��������ͼ��ʾ��B����Һ��pH��7��������Һ����仯������c��HCl����_________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
(12�֣�������ѧ��ѧ��Ӧԭ��������������⣺
��1��ij��Һ��������ͬ���ʵ��������ʣ�������ֻ����OHһ��H����NH4+��Clһ�������ӣ�
��c(NH4+)>c(Cl��)>c(OH��)>c(H��)���������������� ��
��2��0.1 mol��L��1�İ�ˮ��0.05 mol��L��1��ϡ����������ϣ������ӷ���ʽ��ʾ��Ϻ���Һ������ԣ� ��
��3����֪��Ksp(RX)��1��8��10��10��Ksp(RY)��1��5��10��16��Ksp(R2Z)��2��0��10��12����������RX��RY��R2Z�ı�����Һ�У�R��Ũ���ɴ�С��˳���� ��
��4����20 mL���������Ļ��Һ����μ���pH��13��Ba(OH)2��Һ������BaSO4����
����ͼ��ʾ��B����Һ��pH��7(�������
����ֱ�����)����c(HCl)�� mol��L��1.

��5�����¶ȡ��ݻ���ͬ��3���ܱ������У�
���±�Ͷ�뷴Ӧ�������Ӧ(H2(g)��
I2(g) 2HI(g) ��H����14.9 kJ��mol��1)���ں��¡�����������, ��÷�Ӧ��
2HI(g) ��H����14.9 kJ��mol��1)���ں��¡�����������, ��÷�Ӧ��
��ƽ��ʱ���������±���
����˵����ȷ���� ��
A�� ��
�� ��1
B��2
��1
B��2 ��
�� C��a��b��14.9
D��c1��c2��c3
C��a��b��14.9
D��c1��c2��c3

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com