
【题目】硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为:炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下:

已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问題:
(1)下列操作或描述正确的是 _________
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。__________

①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。_____ (填操作),分别加入2滴稀硝酸和6滴15%KSCN,________(填现象),证明晶体II中的杂质含量低于晶体I
(4)某同学称取28.700g研细的皓矾晶体(0.100mol), 置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为_____________
(5)将烟道灰在氧气中髙温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________
【答案】AD⑤④①②取相同质量的晶体I和晶体II,加入相同体积蒸馏水溶解晶体II所得溶液颜色较浅ZnSO4![]() ZnO+SO3灼烧后碳粉与O2反应生成CO2,减少了锌元素的吸附损失
ZnO+SO3灼烧后碳粉与O2反应生成CO2,减少了锌元素的吸附损失
【解析】
(1)A、洗液中含有溶解的ZnSO4,因此将洗涤液与溶液I合并,提高Zn元素的利用,故A正确;B、PbSO4是难溶物,应在固体I中,故B错误;C、加入盐酸,引入新的杂质Cl-,故C错误;D、ZnSO4易溶于水,难溶于乙醇,用95%酒精作为洗涤剂,减少ZnSO4的损失,故D正确;(2)抽滤操作步骤步骤是加入滤纸,然后用蒸馏水润湿滤纸,转移固液混合物,接着微开水龙头,开大水龙头,最后确认抽干,即步骤顺序是加入滤纸→⑤→④→①→②→确认抽干;(3)取相同质量的晶体I和晶体II,加入相同体积蒸馏水溶解,分别加入2滴稀硝酸和6滴15%KSCN,晶体II所得溶液颜色较浅,说明晶体II中的杂质含量低于晶体I;(4)ZnSO4·7H2O全部失去结晶水,发生ZnSO4·7H2O![]() ZnSO4+7H2O,晶体减少的质量是水的质量,即晶体失重0.1×7×18g=12.6g<13.100g,即部分ZnSO4发生分解,因此副反应是ZnSO4
ZnSO4+7H2O,晶体减少的质量是水的质量,即晶体失重0.1×7×18g=12.6g<13.100g,即部分ZnSO4发生分解,因此副反应是ZnSO4![]() ZnO+SO3;(5)灼烧后碳粉与O2反应生成CO2,减少了锌元素的吸附损失。
ZnO+SO3;(5)灼烧后碳粉与O2反应生成CO2,减少了锌元素的吸附损失。


科目:高中化学 来源: 题型:
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物质的量为( )
已知NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O,
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质可以实现一步转化的是( )
A. N2→NO2→HNO3→NH4ClB. Al→Al2O3→Al(OH)3→AlCl3
C. Cu→CuCl2→Cu(OH)2→CuOD. Si→SiO2→H2SiO3→NaSiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数K的说法中,正确的是
A. K的大小与起始浓度有关
B. 温度越高,K值越大
C. K值越大,反应正向进行的程度越大
D. K值越大,反应正向进行的程度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而成,则溶液M的pH________7(填“<”、“>”或“=”),溶液中离子浓度由大到小顺序为________________。已知常温下Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。
(3)若溶液M有下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为_________________。
(4)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________(填“大于”“小于”“等于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、Na+
C.酸性溶液中:Na+、Fe3+、SO42-、Cl-
D.0.1mol/L 的 FeCl3溶液中:Na+、H+、SCN-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分,将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
[提出猜想]
猜想1:该气体为CO2;
猜想2:该气体为SO2;
猜想3:_________________________________________。
为了验证猜想,该小组设计实验加以探究:
[实验探究]该小组同学按如图所示装置,将气体从a端通入,则
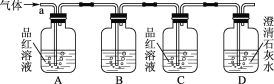
(1)B中应该装下列________试剂(填编号)。
A.NaCl溶液 B.酸性KMnO4溶液 C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是____________________________________。
(3)D中澄清石灰水的作用是________________________________________。
通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色;②C中品红溶液不褪色;③D中澄清石灰水变浑浊,由上述现象该小组同学确认该气体的成分为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
根据设计要求回答:
(1)A中发生反应的离子方程式为:______________________________
(2)B装置有三种功能:①均匀混合气;②干燥混合气体;③______________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应≧________。
(4)E装置的作用是________________________________。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出生成黑色小颗粒的化学方程式___________________________________。
(6)D装置中的石棉上放较多的KI粉末,其作用为________________________________。
(7)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com