
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物质的量为( )
已知NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O,
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
【答案】D
【解析】试题分析:纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO3)2,每个Cu升2价,失2个电子;另一个是HNO3到NaNO2,每个N降2价,得2个电子。51.2gCu共失电子![]() ×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,所以溶液中n(NaNO2)==0.8mol,气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×2mol/L-0.8mol=0.2mol,故选A。
×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,所以溶液中n(NaNO2)==0.8mol,气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×2mol/L-0.8mol=0.2mol,故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1) 固体残渣主要是含________元素的氧化物。
(2)写出Cr2O3与纯碱在高温焙烧时反应的化学方程式_______________________。
(3)高温焙烧后粉碎的目的是_____________________________,调节pH时形成的沉淀的成分是_______________________________________________。
(4)写出硫酸酸化使Na2CrO4转化为Na2Cr2O7的离子方程式 ______________________。
(5)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到Na2Cr2O7的转化,其原理如图所示。写出阳极的电极反应式____________________。
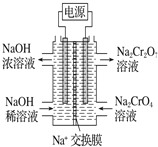
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为________________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是______________。(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,![]() ,
,![]() ,
,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语使用不正确的是
A. 羟基的电子式: ![]() B. 聚丙烯的结构简式:
B. 聚丙烯的结构简式: ![]()
C. 乙酸的实验式:CH2O D. 乙烯的结构简式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )
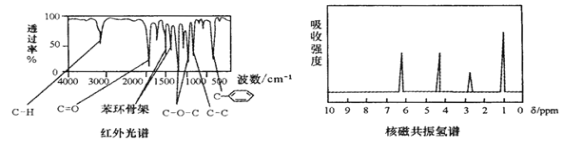
A. 由红外光谱可知,A中含有C-H键、C=O键、![]() 等
等
B. 由核磁共振氢谱可知,该有机物分子中有4种不同化学环境的氢原子
C. 若A的化学式为C8H8O2,则其结构简式可能为![]()
D. 由以上信息可以推测A分子可能为含有酯基的芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是
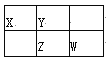
A. Z元素位于周期表的第3周期第VA族
B. X与W形成共价化合物XW2, X的原子半径比Y小
C. Y元素的气态氢化物的热稳定性比Z的高
D. X、W元素的最高价氧化物对应水化物的酸性:W强于X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为:炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下:

已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问題:
(1)下列操作或描述正确的是 _________
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。__________

①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。_____ (填操作),分别加入2滴稀硝酸和6滴15%KSCN,________(填现象),证明晶体II中的杂质含量低于晶体I
(4)某同学称取28.700g研细的皓矾晶体(0.100mol), 置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为_____________
(5)将烟道灰在氧气中髙温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com