
【题目】重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1) 固体残渣主要是含________元素的氧化物。
(2)写出Cr2O3与纯碱在高温焙烧时反应的化学方程式_______________________。
(3)高温焙烧后粉碎的目的是_____________________________,调节pH时形成的沉淀的成分是_______________________________________________。
(4)写出硫酸酸化使Na2CrO4转化为Na2Cr2O7的离子方程式 ______________________。
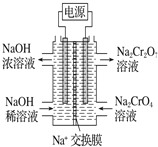
(5)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到Na2Cr2O7的转化,其原理如图所示。写出阳极的电极反应式____________________。
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为________________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是______________。(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,![]() ,
,![]() ,
,![]() ,
,![]() )
)
【答案】铁2Cr2O3+ 4Na2CO3+ 3O2![]() 4Na2CrO4+4CO2增大接触面积,提高水浸效率H2SiO3、Al(OH)32CrO42-+ 2H+= Cr2O72-+ H2O4OH--4e-=O2↑ + 2H2O480C1V1-80C2V23.2~4.3之间
4Na2CrO4+4CO2增大接触面积,提高水浸效率H2SiO3、Al(OH)32CrO42-+ 2H+= Cr2O72-+ H2O4OH--4e-=O2↑ + 2H2O480C1V1-80C2V23.2~4.3之间
【解析】
(1) 铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质),在经过氧气、纯碱高温焙烧后,冷却、水浸后过滤,得到Na2CrO4、Na2SiO3和NaAlO2溶液,固体残渣中一定含有铁元素的氧化物;正确答案:铁。
(2)根据流程可知:Cr2O3与纯碱在高温焙烧时反应生成Na2CrO4和CO2,化学方程式:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2;正确答案:2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2;正确答案:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2。
4Na2CrO4+4CO2。
(3)高温焙烧后粉碎的目的是增大接触面积,提高水浸效率;根据流程可知:含有Na2CrO4、Na2SiO3 和 NaAlO2溶液,调节pH时,最后主要剩余Na2CrO4溶液,说明 SiO32-、AlO2-都转化为沉淀而滤出,所以形成的沉淀的成分是H2SiO3、Al(OH)3;正确答案:增大接触面积,提高水浸效率; H2SiO3、Al(OH)3 。
(4) 硫酸酸化使Na2CrO4转化为Na2Cr2O7过程,铬元素价态没有发生改变,属于非氧化还原反应,离子方程式2CrO42-+ 2H+= Cr2O72-+ H2O;正确答案:2CrO42-+ 2H+= Cr2O72-+ H2O。
(5) 阳极区是Na2CrO4溶液,是碱性环境,Na2Cr2O7存在于酸性环境,Na2CrO4转化为Na2Cr2O7,铬元素的化合价并没有发生变化,只需通过电解提高阳极区溶液的酸性即可使二者间发生转化,故阳极氢氧根离子放电,电极反应式为:4OH--4e-=O2↑+ 2H2O;正确答案:4OH--4e-=O2↑+ 2H2O。
(6)①根据提给信息可知,废液中还原剂转移的电子的量为6×c1V1×10-3-c2×V2×10-3mol,废液中还原剂被氧气氧化,O2被还原为O2-,设氧气的量为xmol,根据电子守恒可知:4x=(6×c1V1×10-3- c2×V2×10-3),x=(6×c1V1×10-3- c2×V2×10-3)/4mol,水样为100.00 mL,COD为(6×c1V1×10-3- c2×V2×10-3)/4mol, 水样为1000.00 mL, COD为[(6×c1V1×10-3- c2×V2×10-3)/4]×32×10=0.480C1V1-0.080C2V2g/L= 480C1V1-80C2V2 mg/L;正确答案:480C1V1-80C2V2 。
②若Fe3+完全沉淀(c(Fe3+)≤10-5),溶液中的pH=-![]() c(H+)=
c(H+)=![]() =-
=-![]() 10-3+
10-3+![]() 3+0.2=3.2;同理可得,Cr3+开始沉淀时,c(OH-)=
3+0.2=3.2;同理可得,Cr3+开始沉淀时,c(OH-)=![]() ×10-10mol/L,pH=-
×10-10mol/L,pH=-![]()
![]() =-
=-![]() 10-4+
10-4+![]() =4+0.3=4.3,故使Fe3+沉淀完全而 Cr3+还未开始沉淀.则需调节溶液pH的范围是3.2~4.3之间;正确答案:3.2~4.3。
=4+0.3=4.3,故使Fe3+沉淀完全而 Cr3+还未开始沉淀.则需调节溶液pH的范围是3.2~4.3之间;正确答案:3.2~4.3。


科目:高中化学 来源: 题型:
【题目】采用下列装置欲验证CaSO4与炭粉受热发生氧化还原反应,且还原产物是SO2。下列有关说法不正确的是
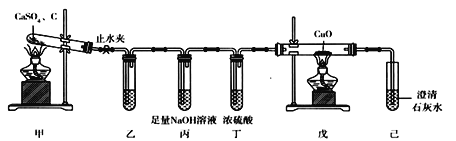
A. 装置乙欲验证气体中的还原产物,故乙中盛有CaSO4溶液
B. 装置丙和装置丁的作用是除去SO2和其他杂质气体
C. 装置戊中黑色粉末变红,己中出现白色沉淀,说明氧化产物有CO
D. 实验结束时,应该先关闭止水夹,再迅速熄灭装置甲中的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在人体内积累可使人慢性中毒,铝及其化合物在下列场合使用时都须加以控制的是( )
①制炊具 ②制防锈油漆 ③用明矾净水 ④用明矾和苏打做食物膨化剂 ⑤用氢氧化铝制药
A.①②③④⑤B.①③④⑤C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是_____________。
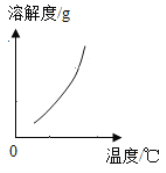
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(右图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是__________________________。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶最终被水充满,无气体剩余,则晶体分解的生成的气体还有________。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是 _________。
④由该实验可得出的结论是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐材料的说法错误的是( )
A. 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
B. 普通玻璃的主要成分是二氧化硅
C. 陶瓷的主要原料是黏土
D. 硅酸盐水泥以石灰石和黏土为主要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法不正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 原子半径:r(A)<r(C)<r(B)
C. 甲、乙可能都具有漂白性
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物质的量为( )
已知NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O,
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质可以实现一步转化的是( )
A. N2→NO2→HNO3→NH4ClB. Al→Al2O3→Al(OH)3→AlCl3
C. Cu→CuCl2→Cu(OH)2→CuOD. Si→SiO2→H2SiO3→NaSiO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com