
将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:
2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol ·L-1,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol ·L-1,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol ·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol ·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol ·L-1
A.①③ B.①④ C.②③ D.③④
科目:高中化学 来源: 题型:
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
实验步骤如下:

(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3
C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为________________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧热的热化学方程式:
_____________________________________________________________________。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为_______________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
 2Z + FeG2
2Z + FeG2 Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为_______________________:
充电时,_____________(写物质名称)电极接电源的负极,该电池的电解质为___________________。
II. 如图是甲烷燃料电池原理示意图,回答下列问题:
(1)电池的负极是__________(填“a”或“b”),该极的电极反应是:__________。

(2)电池工作一段时间后电解质溶液的pH__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中导电性最强的是
A.5L 0.1 mol ·L-1NH3·H2O B.5L mol ·L-1 盐酸
C.0.1L 0.1 mol ·L-1H3PO4溶液 D.0.1L 0.1 mol ·L-1 Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g)在不同情况下测得反应速率,其中反应速率最快的是
A.υ(A)=0.1 mol ·L-1·s-1 B.υ(B)=0.6 mol ·L-1·s-1
C.υ(C)=0.5 mol ·L-1·s-1 D.υ(D)=0.4 mol ·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g+Y(g) Z(g)+W(s) ΔH>0 下列叙述正确的是
Z(g)+W(s) ΔH>0 下列叙述正确的是
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol•L-1)变化
| 时间/ min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。
在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率 (填“变大”“不变”“变小”)
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“>”、“=”、“<”).
II:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g)⇌ CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 |
(1)该反应的Q 0(选填“<”、“>”或“=”,下同),K1 K2。
(2)300℃时,该反应的平衡常数为 。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是
A.原子序数: X<Y B.原子半径:X<Y
C.离子半径:X>Y D.原子最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
据新闻网报道:科学家首次合成第117号元素,被美国《时代》周刊评选为当年十大科学发现。假如第117号元素符号暂时定为Up,下列关于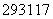 Up和
Up和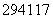 Up的说法中正确的是( )
Up的说法中正确的是( )
A.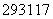 Up和
Up和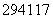 Up是两种元素
Up是两种元素
B.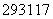 Up和
Up和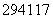 Up互为同位素
Up互为同位素
C.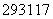 Up和
Up和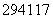 Up质子数不同、中子数相同
Up质子数不同、中子数相同
D.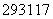 Up和
Up和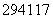 Up质量数相同、电子数不同
Up质量数相同、电子数不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com