
| 10-14 |
| 0.1 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
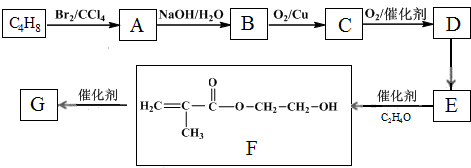
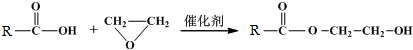
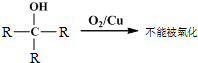
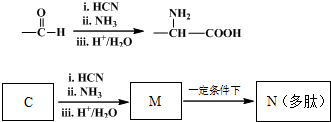
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
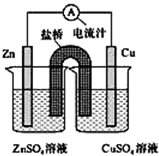 如图为一原电池的装置示意图,下列说法不正确的是( )
如图为一原电池的装置示意图,下列说法不正确的是( )| A、原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| B、原电池工作时,电流由铜极流经电流计流向锌极 |
| C、原电池工作时,盐桥中K+移向CuSO4溶液 |
| D、如果将Cu电极与Zn电极互换,电流计指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-、K+、Fe3+、NO3- |
| B、HCO3-、OH-、Cl-、K+ |
| C、Mg2+、NO3-、H+、Al3+ |
| D、SO42-、Ag+、NH4+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com