
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
分析 (1)根据现象H2O2溶液与FeSO4溶液反应生成铁离子,铁元素化合价升高,则过氧化氢生成水;
(2)生成铁离子,能催化过氧化氢分解生成氧气;
(3)硫酸根离子用酸化的氯化钡检验;
(4)①根据实验II记录反应后溶液pH=1.4,酸性增强,假设i不合理;
②根据假设ii,Fe2+氧化的产物发生了水解,则为铁离子水解,取硫酸铁验证即可;
(5)根据假设ii为过氧化氢氧化亚铁离子为铁离子,铁离子发生水解生成氢氧化铁胶体;
(6)用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,该气体能使湿润的蓝色石蕊试纸变红但不褪色,为HCl气体;
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与pH、阴离子种类、温度、反应物用量有关.
解答 解:(1)H2O2溶液与FeSO4溶液反应生成铁离子和水,离子方程式为:2Fe2++2H++H2O2=+2Fe3++2H2O;
故答案为:2Fe2++2H++H2O2=+2Fe3++2H2O;
(2)过氧化氢在铁离子催化作用下分解生成氧气,故产生气泡;
故答案为:Fe3+催化下H2O2分解生成O2;
(3)硫酸根离子用酸化的氯化钡检验,故检验棕黄色沉淀中SO42-的方法是:取加入盐酸后的黄色溶液少许于试管中,加入BaCl2溶液,产生白色沉淀,说明棕黄色沉淀中含有SO42-;
故答案为:取加入盐酸后的黄色溶液少许于试管中,加入BaCl2溶液,产生白色沉淀,说明棕黄色沉淀中含有SO42-;
(4)①根据实验II记录反应后溶液pH=1.4,酸性增强,假设i中消耗氢离子,酸性减弱,pH应增大,故不合理;
故答案:反应后溶液的pH降低;
②根据假设ii,Fe2+氧化的产物发生了水解,铁离子水解,验证硫酸铁溶液中铁离子的水解平衡即可,取Fe2(SO4)3溶液,加热,溶液变为红褐色,pH下降,证明假设 ii成立;
故答案为:Fe2(SO4)3溶液;
(5)根据假设ii,为过氧化氢氧化亚铁离子为铁离子,铁离子发生水解生成氢氧化铁胶体,反应为:2Fe2++4H2O+H2O2=+2Fe(OH)3(胶体)+2H+;
故答案为:2Fe2++4H2O+H2O2=+2Fe(OH)3(胶体)+2H+;
(6)用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,H2O2分解反应放热,促进Fe3+的水解平衡正向移动,产生的HCl受热挥发;
故答案为:H2O2分解反应放热,促进Fe3+的水解平衡正向移动,产生的HCl受热挥发;
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与pH、阴离子种类、温度、反应物用量有关;
故答案为:pH、阴离子种类、温度、反应物用量.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据物质的性质进行实验原理分析及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.


科目:高中化学 来源: 题型:推断题
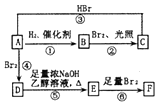 烯烃A在一定条件下可以按下而的流程进行反应.
烯烃A在一定条件下可以按下而的流程进行反应.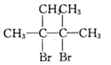
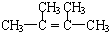 .
.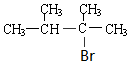 .
.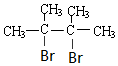 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$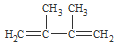 +2NaBr+2H2O.
+2NaBr+2H2O.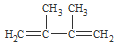 +2Br2→
+2Br2→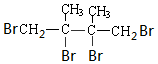 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
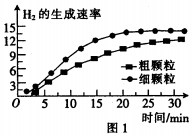

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
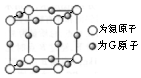 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 滴定到终点读数时,发现滴定管尖嘴内有气泡 | |
| D. | 配制标准溶液的NaOH中混有KOH杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
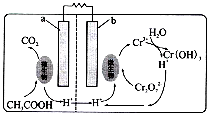
| A. | b极为负极 | |
| B. | a极反应式:CH3COOH+2H2O-8e-=2CO2+8H+ | |
| C. | 每处理1mol Cr2O72-生成CO2(标准状况下)3.36 L | |
| D. | 每生成lmol Cr(OH)3,右池n(H+)减少2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(浓)$\stackrel{Fe}{→}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s) | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | SiO2$→_{△}^{NaOH(AQ)}$Na2SiO3(aq)$\stackrel{足量CO_{2}}{→}$H2SiO3 | |
| D. | NaAlO2$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$AlCl3(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com