
 可与食盐制取浓HCl、浓HCl可与KMnO4制取C
可与食盐制取浓HCl、浓HCl可与KMnO4制取C l2,选用
l2,选用 下图所示装置(含有所盛放的试剂)设计实验。
下图所示装置(含有所盛放的试剂)设计实验。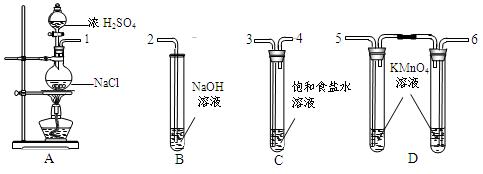
 HCl,Cl2的化学反应方程式:
HCl,Cl2的化学反应方程式: _________________________________。
_________________________________。科目:高中化学 来源:不详 题型:实验题
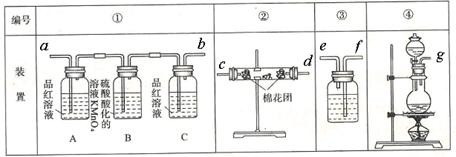
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
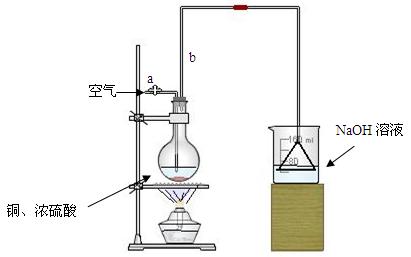
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
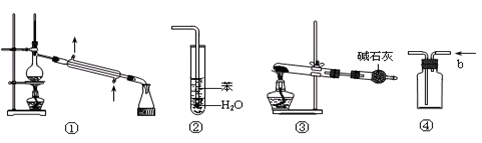
| A.装置①可用于制取少量的蒸馏水 |
| B.装置②可用于吸收NH3,并防止倒吸 |
| C.以NaHCO3为原料,装置③可用于实验室制取少量CO2 |
| D.装置④b口进气可收集Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 越大。
越大。
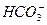 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7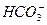

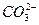 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11 H++
H++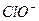 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8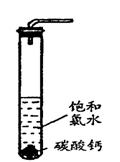
 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
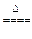 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si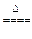 Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430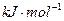 )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题: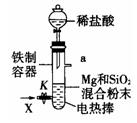
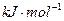 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com