
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.25Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,体积最大的是Z
B. 同温同压下,三种气体密度最小的是Z
C. 同温同压下,同质量的三种气体体积最大的是X
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为4∶1
科目:高中化学 来源: 题型:
【题目】三位科学家保罗·克拉兹等因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如下图所示:

下列说法不正确的是( )
A.氯原子在反应中做催化剂 B.过氧化氯的结构式为:O—Cl—Cl—O
C.臭氧分子最终转变成氧气分子 D.过程②中一氧化氯断键形成过氧化氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构与元素性质的说法正确的是( )
A. 同种元素的原子均有相同的质子数和中子数
B. 全部由非金属元素组成的化合物中只含共价键
C. ⅦA族元素是同周期中非金属性最强的元素
D. 同一主族的元素,原子半径越大,其单质的熔点一定越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A. K+、Ba2+、OH-、SO42- B. Cu2+、NH4+、Br-、OH-
C. H+、NO3-、Fe2+、Na+ D. Ag+、Cl-、Fe2+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R2-所含有电子的物质的量是
A. mol B. mol C. (m-n-2)mol D. (m-n+2)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() (注:R、R′为烃基)。A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化:
(注:R、R′为烃基)。A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化:
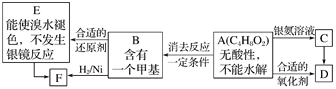
则A的结构简式是( )
A. CH3OHCH=CHCHO B. CH3CH2COOCH3
C. CH3CHOHCH2CHO D. CH2OHCH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 3 mol·L-1的KClO3 B. 75 mL 2 mol·L-1的NH4Cl
C. 350 mL 3 mol·L-1的NaCl D. 150 mL 0.5mol·L-1的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:

已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________(任写一种)。请写出其中发生的氧化还原反应离子方程式: _________。滤渣的成分为S单质和_________。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O![]() Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
(3) 简述检验沉淀是否洗净的实验方法: _________,若未出现浑浊则证明沉淀己洗干净,反之则没有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
(1)①1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是_______________________________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
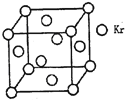
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com