
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
(1)①1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是_______________________________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
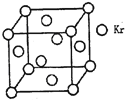
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
【答案】 10 N>C>O 6 1s22s22p63s23p63d6 或【Ar】3d6 高 HCOOH分子间能形成氢键 de 正四面体 sp2 3
【解析】(1)①单键为σ键,双键中含有1个σ键,1个π键,![]() 中共有10个σ键,所以1mol PAN中含有的σ键数目为10mol;一般非金属性越强第一电离能越弱,同周期随原子序数增大第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C;
中共有10个σ键,所以1mol PAN中含有的σ键数目为10mol;一般非金属性越强第一电离能越弱,同周期随原子序数增大第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C;
②Fe2+含有空轨道,为中心离子,NO、H2O含有孤对电子,为配体,该配合物中中心离子的配位数为6,Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子形成Fe2+,Fe2+的核外电子排布式为:1s22s22p63s23p63d6;
③HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,HCOOH的沸点比CH3OCH3高;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键,故答案为de;
②NH4+的中心原子氮原子价层电子对数=![]() =4,孤电子对=
=4,孤电子对=![]() =0,所以NH4+的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=
=0,所以NH4+的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=![]() =3,所以氮原子按sp2 方式杂化;
=3,所以氮原子按sp2 方式杂化;
(3)与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×![]() +6×
+6×![]() =4,则
=4,则![]() =
=![]() =3。
=3。
电子对数 目 | 电子对的空间构型 | 成键电子对数 | 孤电子 | 电子对的 | 分子的 | 实 例 |
2 | 直 线 | 2 | 0 |
| 直 线 | BeCl2 |
3 | 三角形 | 3 | 0 |
| 三角形 | BF3 |
2 | 1 |
| V-形 | SnBr2 | ||
4 | 四面体 | 4 | 0 |
| 四面体 | CH4 |
3 | 1 |
| 三角锥 | NH3 | ||
2 | 2 |
| V-形 | H2O | ||
5 | 三角 | 5 | 0 |
| 三角双锥 | PCl5 |
4 | 1 |
| 变形 | SF4 | ||
3 | 2 |
| T-形 | BrF3 | ||
2 | 3 |
| 直线形 | XeF2 | ||
6 | 0 |
| 八面体 | SF6 | ||
6 | 八面体 | 5 | 1 |
| 四角锥 | IF5 |
4 | 2 |
| 正方形 | XeF4 |


科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.25Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,体积最大的是Z
B. 同温同压下,三种气体密度最小的是Z
C. 同温同压下,同质量的三种气体体积最大的是X
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与卤素单质化学性质相似的物质称为拟卤素或类卤素,如氰气,它的结构式为N≡C—C≡N,下列说法不正确的是( )
A. 其中叁键的键长比单键要短 B. 分子中含3个σ键和4个π键
C. 分子构型为直线形 D. 可以发生加成反应,但不能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
C. 基态Fe原子的外围电子排布图为![]()
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量浓度、等体积的下列物质的溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3下列关系或者说法正确的是( )
A.c(CO![]() )的大小关系为②>⑤>③>④>①
)的大小关系为②>⑤>③>④>①
B.c(HCO![]() )的大小关系为④>③>⑤>②>①
)的大小关系为④>③>⑤>②>①
C.将溶液蒸干、灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,可以完成许多电化学实验。下列有关此装置的叙述中,正确的是

A.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中阳离子向碳棒电极移动
C.若X为碳棒,Y为硫酸铜溶液,开关K置于M处,碳棒质量将增加,此时外电路中的电子向碳电极移动
D.若X为铜棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅单质及其化合物的说法正确的是( )
①水玻璃是一种矿物胶,既不易燃烧也不易腐蚀 ②水泥、玻璃、沙子都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com